
系统性红斑狼疮(SLE)是一种异质性极强的慢性自身免疫性疾病,其核心病理特征是 B 细胞耐受被打破,产生大量针对核抗原的自身抗体,进而引发全身性炎症和器官损伤。在自身抗体产生的过程中,滤泡外(EF)B 细胞分化途径是自身抗体分泌细胞(ASCs)的主要来源,与疾病活动度密切相关。其中,CD21 低表达(CD21lo)、CD11c 高表达的 B 细胞亚群在衰老、感染及自身免疫病中富集,被证实是滤泡外 ASCs 的关键前体,但这类细胞的发育轨迹和受体调控机制尚未明确。
toll 样受体 7(TLR7)作为识别单链 RNA 的固有免疫受体,在SLE发病中扮演重要角色,其激活可促进B细胞耐受逃逸和自身抗体产生;而补体受体21(CD21)作为B细胞受体(BCR)的共受体,本应促进B细胞活化,却在狼疮相关B细胞亚群中呈低表达状态,这一矛盾现象暗示CD21在自身免疫中的作用可能更为复杂。为解决上述科学问题,研究团队建立了TLR7驱动的过继转移狼疮模型,系统探究了CD21在自身反应性 B 细胞滤泡外分化中的调控作用及分子机制。
研究团队将野生型(WT)和TLR7敲除(Tlr7-KO)小鼠的脾脏B细胞以1:1 比例过继转移至 564Igi 转基因宿主小鼠中,该宿主可提供富含核抗原和T细胞辅助的自身免疫微环境。追踪7天后发现,Tlr7-KO来源的成熟B细胞、生发中心(GC)B 细胞及非GC B细胞数量均显著减少,其中ASCs和DN2样细胞(CD11c+CD21-)分别减少24倍和9.7倍,证实B细胞耐受打破和生发中心发育依赖 TLR7 信号。进一步通过 Bcl6 条件敲除小鼠阻断生发中心形成后,ASCs 数量未受影响,结合时间动力学分析显示 WT 供体 B 细胞从第4天开始扩增,第 5 天起在脾脏红髓区出现 ASCs 聚集,明确该模型中自身反应性B细胞主要通过滤泡外途径分化为 ASCs,且依赖 TLR7 信号驱动。
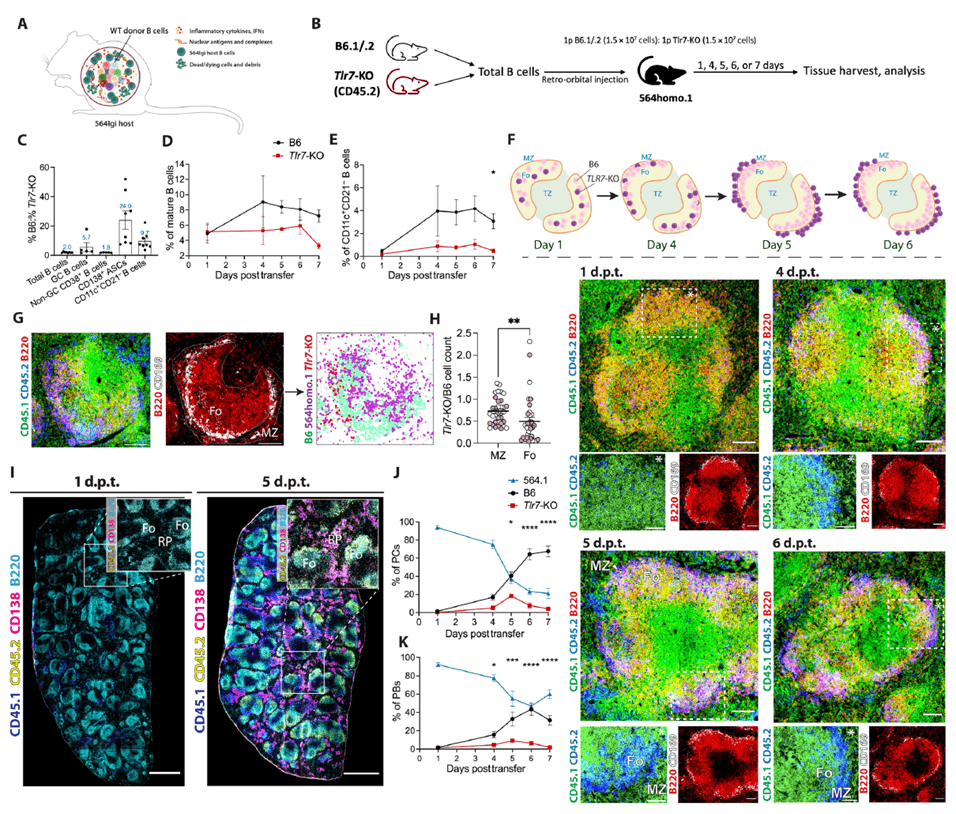 Figure 1. 564lgi的移植模型依赖于TLR7,并支持自反应B细胞EF分化
Figure 1. 564lgi的移植模型依赖于TLR7,并支持自反应B细胞EF分化
为解析 B 细胞增殖与分化的关联,研究团队采用 CellTrace Violet(CTV)标记供体 B 细胞,发现供体 B 细胞增殖过程中 CD21 表达逐渐下调,且大多数 ASCs 需经历至少7轮分裂后形成。通过表型分群将供体B细胞分为边缘区样、滤泡样和
DN2 样亚群后,发现 CD21loCD23 - 亚群以终末分裂细胞为主,而 Tlr7-KO
小鼠的该亚群中静止期细胞比例显著升高,难以完成终末分裂。同时,后期分裂中 ASCs 相关转录因子 BLIMP1 和 IRF4
表达上调,表明自身反应性 ASCs 分化存在预设的分裂程序,而CD21下调与TLR7信号依赖密切相关,TLR7缺陷会阻碍 B 细胞通过连续细胞周期完成增殖和分化。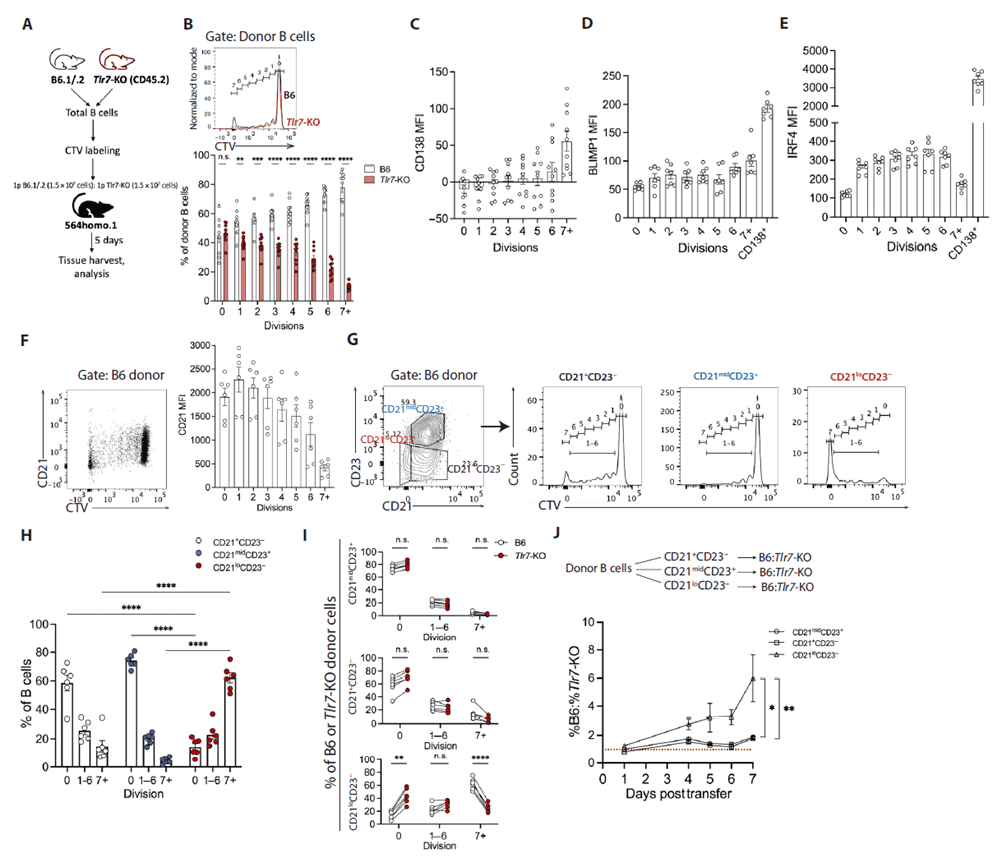
Figure 2. 原发性自身反应性B细胞在固定分裂-分化程序中下调CD21并建立TLR7敏感性
利用 CD21-cre×Rosa26Lox-Stop-Lox-tdTomato 工具鼠进行命运追踪,发现过继转移后7天,564Igi 宿主中供体来源的 CD21loCD23 - 细胞几乎均为 TdTOM+,证实其起源于初始 CD21+ B 细胞而非预先存在的 CD21lo 细胞库。通过 serial 过继转移实验,将初级转移后分选的CD21lo细胞和滤泡 B 细胞(FoB)转移至次级 564Igi 宿主,发现 CD21lo 细胞更倾向于分化为 CD138+ ASCs,而滤泡 B 细胞则优先形成生发中心 B 细胞。体外培养实验进一步证实,CD21lo 细胞在 TLR7 激动剂和细胞因子刺激下,可高效分化为类浆细胞表型,并产生大量针对胞质成分的自身抗体,明确CD21lo 细胞是滤泡外 ASCs 的直接前体,具有强大的自身抗体分泌潜能。
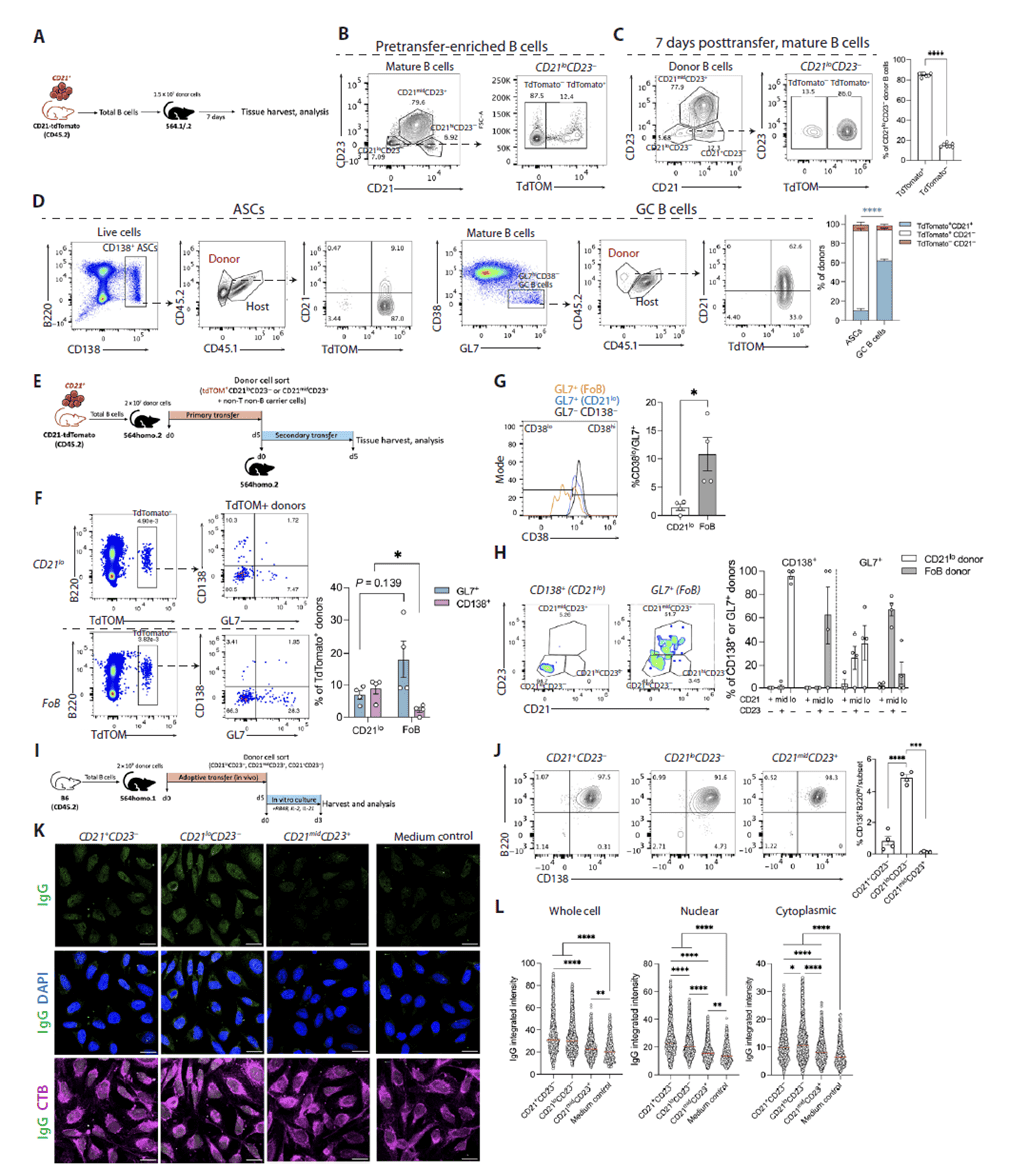
Figure 3. CD21lo细胞来源于 CD21+ 细胞,并处于ASCs和自身抗体的产生状态
研究团队单独分选初始滤泡 B 细胞(CD21midCD23+)、边缘区 B 细胞(CD21hiCD23-CD1d+IgM+)和过渡型 T1 B 细胞转移至 564Igi 宿主,发现初始滤泡 B 细胞在转移后 5.5 天即可产生 CD21loCD23 - 亚群,且经历至少 7 轮分裂的细胞中大部分表达 CD138。终末分裂细胞中
CD21loCD23 - 亚群占比显著升高,且单个小鼠的初始滤泡 B 细胞可贡献约 20% 的总 ASCs。相比之下,边缘区 B
细胞虽能产生少量 ASCs,但大部分保留原始表型;T1 B 细胞则无法有效分化为 ASCs,证实初始滤泡 B 细胞是 CD21lo
前体和早期自身反应性 ASCs 的主要来源,且需通过 CD21lo 中间状态完成滤泡外分化。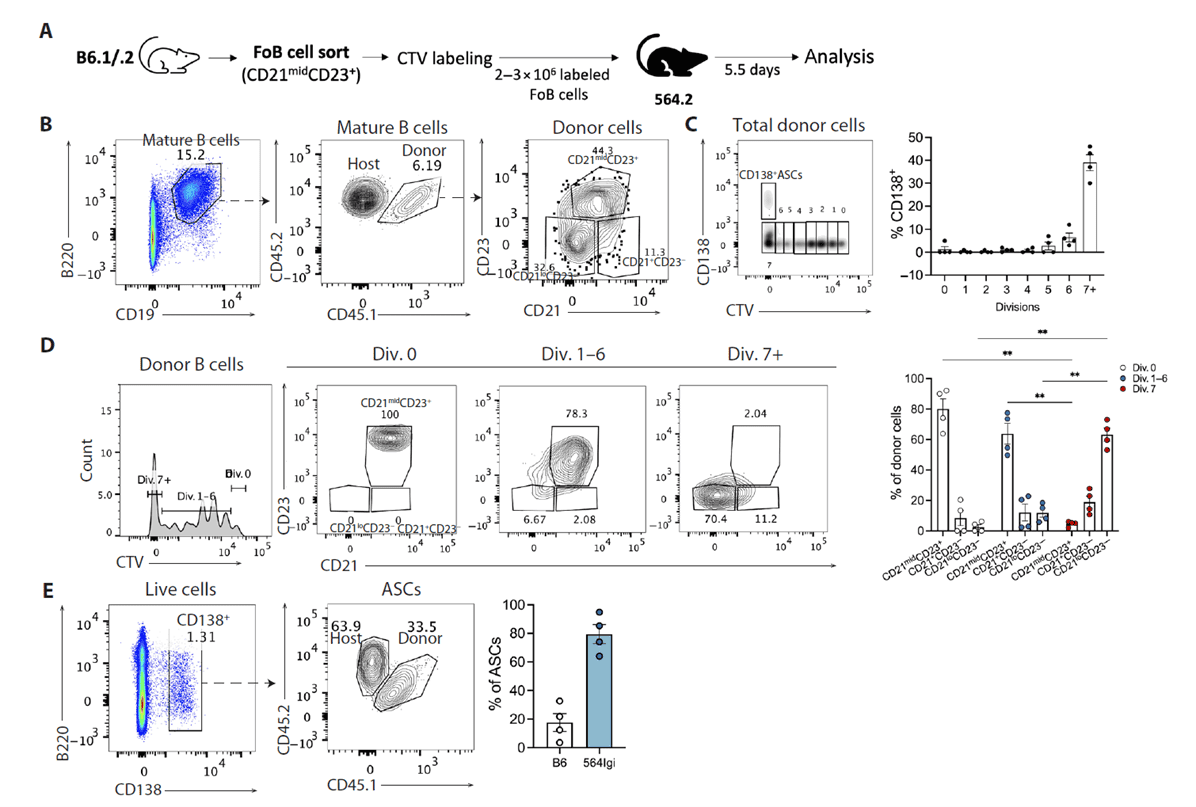
Figure 4. CD21+ASC前体B细胞来源于无髓骨髓基质细胞(FoB)
为明确初始滤泡B细胞(FoB)向自身反应性细胞分化的克隆演化规律,研究团队对过继转移后 6.5 天的供体 B 细胞亚群进行 bulk BCR 重链和轻链测序。Hill多样性分析显示,CD21lo细胞的受体库多样性最低、克隆扩增最显著,而ASCs虽克隆丰富度较高,但优势克隆权重更大,表明 CD21lo 细胞是过渡性效应前体,ASCs 存在严格的克隆选择。κ/λ 轻链比值分析发现,生发中心 B 细胞的 κ/λ 比值与初始 FoB 差异最大,而 CD21lo 细胞比值较低,提示其处于选择早期阶段。此外,CD21lo 细胞与 ASCs 共享 Ighv1–82、Ighv1–80 等重链基因家族的优势扩增,且均高频率出现 Ighv1–72 与 Ighj4 的配对模式;系统发育树分析显示,ASCs中最扩增的克隆与 564Igi 自身反应性重链序列同属一个进化分支,且 CD21lo 细胞中存在向 ASCs 分化的过渡性 BCR 序列,证实初始 FoB 通过克隆选择和受体进化逐步获得自身反应性,CD21lo 细胞是这一演化过程的关键中间阶段。
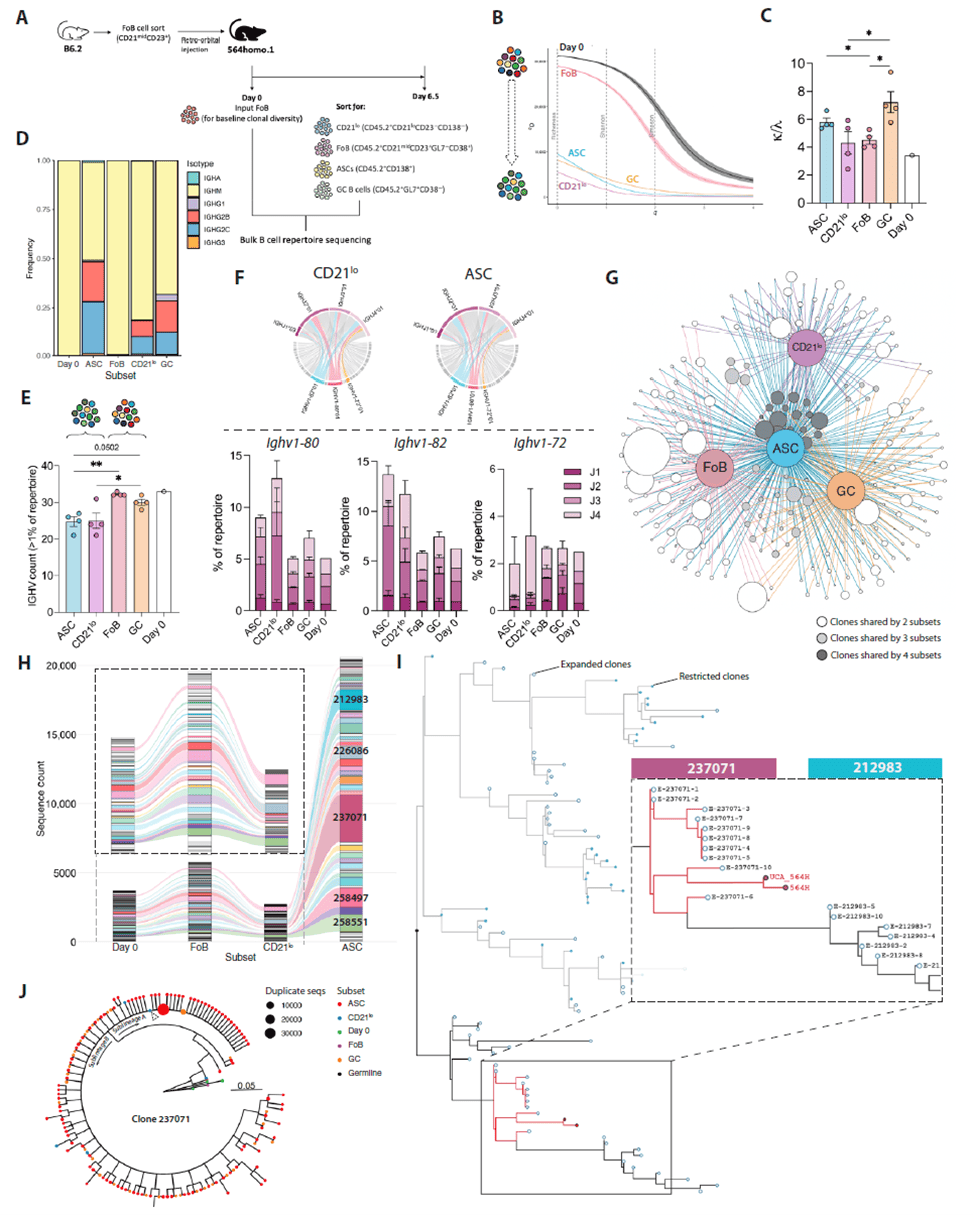
Figure 5. B细胞库测序揭示了FoB细胞向自身反应发展的轨迹
为验证 CD21 在自身反应性 B 细胞分化中的功能性作用,研究团队采用 CD21 敲除小鼠和人 CD21 转基因小鼠模型。发现 mCd21-KO 供体 B 细胞虽在早期分裂中比例升高,但难以进入终末分裂,提示 CD21 缺失虽不影响早期活化,但阻碍增殖进程。进一步使用抗 hCD21 单克隆抗体阻断 hCD21+ B 细胞的 C3d 结合位点,发现抗体处理后供体 B 细胞的成熟细胞维持不受影响,但终末分裂细胞比例降低、ASCs 生成减少,脾脏红髓区 ASCs 数量显著减少。同时,CD21 阻断可维持 CD21 + 细胞群体,减少 CD21loCD23 - 细胞比例,且体外实验证实,CD21 与 C3d/iC3b 配体结合可触发其快速下调,而抗体阻断或 C3 缺失可完全抑制这一过程,表明 CD21 配体结合是其下调的关键驱动因素,功能阻断可通过抑制 CD21 下调和增殖进程,最终减少 ASCs 生成。
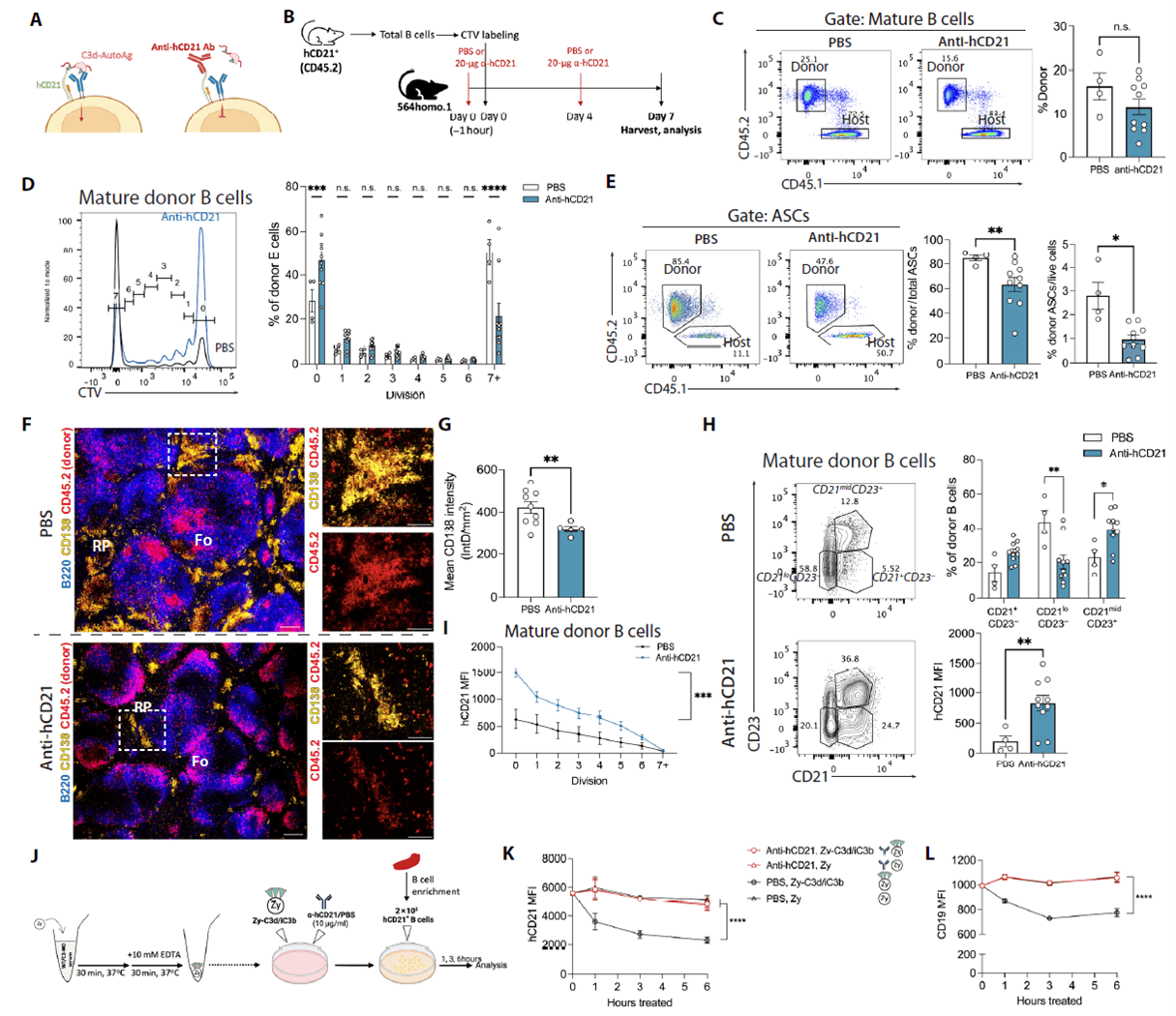
Figure 6. 在增殖过程中,CD21的下调通过功能阻断受体来抑制
通过CD21-tdTomato 小鼠的 serial 过继转移实验,研究团队发现初级转移形成的 CD21lo 细胞在次级 564Igi 宿主中,部分可恢复 CD21 表达,证实 CD21lo 状态并非不可逆,而是依赖微环境中配体的持续存在。体外延迟阻断实验显示,在 B 细胞与 C3d/iC3b 颗粒共孵育 1-5 小时后加入 CD21 阻断抗体,CD21 下调立即停止,且下调程度与配体暴露时间正相关,表明 CD21 完全下调需要配体持续结合。体内延迟阻断实验进一步证实,转移后 3 天给予抗体处理,供体 B 细胞增殖虽未完全停止,但 CD21 表达水平维持在转移后 3 天的状态,且终末分裂细胞中出现 CD21 表达双峰分布;同时,转移后 3 天的供体 B 细胞多处于未分裂状态,而 7 天组无论是否阻断均已进入终末分裂,明确 CD21 下调发生在细胞增殖之前,是 B 细胞活化的早期事件,其完全下调可能是自身反应性 B 细胞向 ASCs 分化的关键命运节点,未完全下调的细胞可通过恢复 CD21 表达改变分化方向。
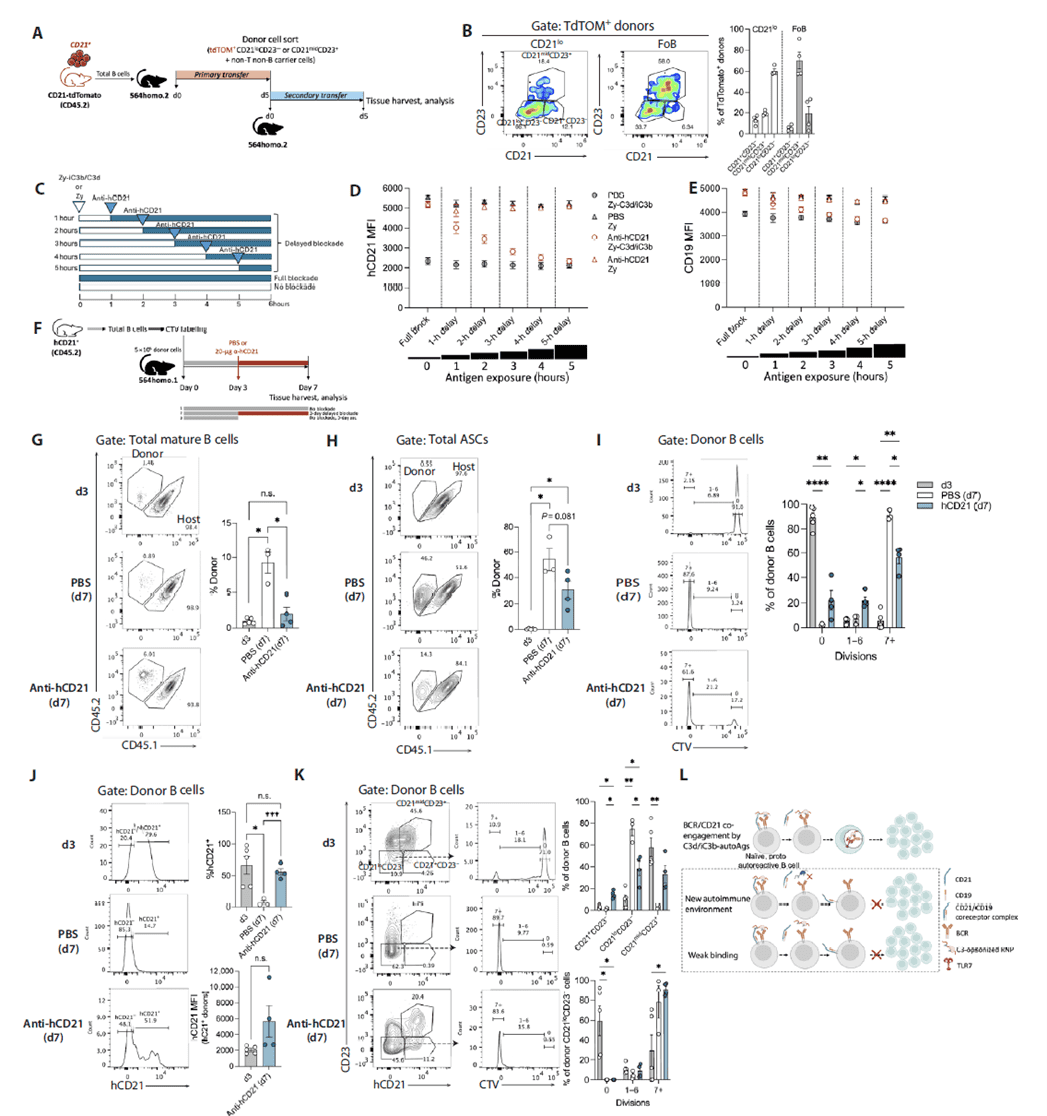
Figure 7. CD21下调需要持续的配体结合,并且在B细胞增殖之前发生
本研究通过细胞命运、克隆演化和分子调控三个层面,完整解析了自身反应性 B 细胞滤泡外分化的机制,不仅明确了 CD21lo 细胞的起源、分化潜能及调控机制,还通过功能阻断实验证实 CD21 和 TLR7 的治疗价值 —— 二者分别作用于分化的起始和维持阶段,联合靶向可更精准地抑制自身反应性 B 细胞活化,为 SLE 治疗提供了 “双靶点” 干预的新策略,同时也为理解感染、衰老中类似 B 细胞亚群的功能提供了机制参考。
abinScience 品牌创立于法国斯特拉斯堡,依托该地区卓越的科研创新生态,专注于高质量生命科学试剂的研发与生产。abinScience始终秉持“Empowering Bioscience Discovery”的愿景,致力于为全球科研人员提供高效、可靠的实验解决方案,赋能前沿生命科学研究。
以下为 abinScience 提供的相关蛋白与抗体产品清单:
| Target | Type | Catalog No. | Product name |
| CD21 | Protein | HB939012 | Recombinant Human CD21/CR2 Protein, N-GST |
| MB939011 | Recombinant Mouse CD21/CR2 & CR1L Protein, C-His | ||
| HB939011 | Recombinant Human CD21/CR2 Protein, C-His | ||
| HB939022 | Recombinant Human CD21/CR2 Protein, N-His | ||
| Antibody | HB939107 | Anti-Human CD21/CR2 Antibody (HB5) | |
| HB939207 | Anti-Human CD21/CR2 Antibody (SAA1459) | ||
| HB939117 | Anti-Human CD21/CR2 Antibody (HB5), FITC | ||
| HB939217 | Anti-Human CD21/CR2 Antibody (SAA1459), FITC | ||
| HB939137 | Anti-Human CD21/CR2 Antibody (HB5), APC | ||
| HB939237 | Anti-Human CD21/CR2 Antibody (SAA1459), APC | ||
| HB939147 | Anti-Human CD21/CR2 Antibody (HB5), PerCP | ||
| HB939247 | Anti-Human CD21/CR2 Antibody (SAA1459), PerCP | ||
| HB939127 | Anti-Human CD21/CR2 Antibody (HB5), PE | ||
| HB939227 | Anti-Human CD21/CR2 Antibody (SAA1459), PE | ||
| HB939307 | Anti-Human CD21/CR2 Antibody (Ab652) | ||
| HB939317 | Anti-Human CD21/CR2 Antibody (Ab652), FITC | ||
| HB939327 | Anti-Human CD21/CR2 Antibody (Ab652), PE | ||
| HB939337 | Anti-Human CD21/CR2 Antibody (Ab652), APC | ||
| HB939347 | Anti-Human CD21/CR2 Antibody (Ab652), PerCP | ||
| TLR7 | Protein | HV024012 | Recombinant Human TLR7 Protein, N-His |
| Antibody | HV024014 | Anti-TLR7 Polyclonal Antibody | |
| HV024013 | Anti-Human TLR7 Antibody (SAA1718) | ||
| BCR | Protein | HY023012 | Recombinant Human BCR Protein, N-His |
| HP839012 | Recombinant Human BCR/ABL Protein, N-His-SUMO | ||
| Antibody | HY023014 | Anti-BCR Polyclonal Antibody | |
| HP839014 | Anti-Human BCR/ABL Polyclonal Antibody | ||
| HY023013 | Anti-Human BCR Antibody (SAA1570) | ||
| PTX19569 | Anti-BCR Polyclonal Antibody | ||
| PTX20541 | Anti-Human BCR/ABL Polyclonal Antibody | ||
| CD19 | Protein | HB996012 | Recombinant Human CD19 Protein, N-His |
| HB996011 | Recombinant Human CD19 Protein, C-His | ||
| Antibody | HB996116 | Research Grade Anti-Human CD19 (ALLO-501) | |
| HB996126 | Research Grade Anti-Human CD19 & CD3E Bispecific Antibody (AMG 562) | ||
| HB996136 | Research Grade Anti-Human CD19 (VB119) | ||
| HB996146 | Research Grade Anti-Human CD19 (UCART19) | ||
| HB996417 | Anti-Human CD19 Antibody (FMC63), FITC | ||
| HB996737 | Anti-Human CD19 Antibody (SAA2206), APC | ||
| HB996747 | Anti-Human CD19 Antibody (SAA2206), PerCP | ||
| MB996014 | Anti-Mouse CD19 Polyclonal Antibody | ||
| HB996023 | Anti-Human CD19 Nanobody (SAA1246) | ||
| HB996033 | Anti-Human CD19 scFv Antibody (FMC63) | ||
| HB996043 | Anti-Human CD19 Nanobody (SAA2078) | ||
| HB996013 | Anti-CD19 & CD28 Bispecific Antibody (RG-6333) |
联系我们: 如需产品咨询,请访问 abinScience 联系我们的支持团队。
使用abinScience的相关研究工具,加速您的研究。
返回顶部