
cGAS–STING 通路是近年来病毒学、肿瘤免疫、放疗敏感性和自身炎症研究中的高频信号轴: 胞质 DNA(来源于 DNA 病毒、线粒体损伤、核 DNA 泄漏或微核等)被 环状 GMP-AMP 合成酶(cyclic GMP-AMP synthase,cGAS)识别后合成 2′3′-环状 GMP-AMP(2′3′-cGAMP),激活内质网膜上的 干扰素基因刺激蛋白(stimulator of interferon genes,STING), 随后驱动 TANK 结合激酶 1(TANK-binding kinase 1,TBK1)、 干扰素调节因子 3(interferon regulatory factor 3,IRF3) 与 核因子 κB(Nuclear Factor kappa B,NF-κB),诱导 干扰素-β(interferon beta,IFN-β) 和一系列 干扰素刺激基因(interferon-stimulated genes,ISGs)。
本篇只关心:cGAS–STING 通路要测哪些指标?各自代表什么?在什么实验平台上最好用?
| 指标 | 常用位点 / 读出 | 代表意义 | 推荐样本 / 方法 | 使用提示 |
| cGAS 表达与定位 | cGAS 总蛋白;胞质 / 微核内 cGAS 斑点 | 细胞是否具备 DNA 感知能力;微核或损伤 DNA 是否被 cGAS “包裹” | 免疫印迹(Western blot);免疫荧光 / 共聚焦 | 放疗或基因不稳模型里,cGAS 在微核上形成斑点,叙事非常直观 |
| cGAMP 水平 | 胞内 2′3′-cGAMP 含量 | cGAS 催化活性的直接产物(机制性 readout) | 液相色谱-串联质谱(LC–MS/MS);cGAMP 检测试剂盒 | 适合验证 cGAS 突变或抑制剂是否真正影响“酶活” |
| STING 总蛋白与定位 | STING 总蛋白;STING 从内质网向高尔基体/囊泡结构转运(puncta) | 细胞是否具备 STING 轴;激活时出现“周核斑点”常有说服力 | 免疫印迹;免疫荧光 / 共聚焦 | 建议配合高尔基体标记(如 GM130)辅助解释“转运” |
| STING 磷酸化 | p-STING(人 Ser366;鼠 Ser365) | STING 激活状态 readout | 免疫印迹 | 通常与 p-TBK1、p-IRF3 联合检测,构成“轴是否被拉起”的证据链 |
| TBK1 激活 | p-TBK1(Ser172) | 关键枢纽激酶是否被激活 | 免疫印迹 | TBK1 也可被其他模式识别受体通路激活,需结合 STING/IRF3 指标定位输入来源 |
| IRF3 激活 | p-IRF3(Ser396/Ser386);IRF3 二聚化或核转位 | IRF3 是否进入转录激活状态(IFN-β 关键上游) | 免疫印迹(单体/二聚体);免疫荧光(核转位) | “p-IRF3 + IFN-β/ISGs”通常是最被接受的组合 |
| NF-κB 支路 | p-p65(Ser536)、IκBα 降解 | STING 激活引发炎症支路(与 IFN 轴并行) | 免疫印迹 | 如果课题偏“炎症 + 干扰素混合表型”,建议把 NF-κB readout 纳入 panel |
| IFN-β 输出 | IFNB1 转录水平;IFN-β 蛋白分泌量 | “轴最终有没有输出”的关键 readout | 实时定量 PCR;酶联免疫吸附试验(ELISA) | 常与 ISGs 联用,增强稳定性(单看 IFN-β 有时波动大) |
| ISGs 与趋化因子 | ISG15、MX1、OAS1、CXCL10(IP-10)等 | 反映 I 型干扰素信号的扩增 | 实时定量 PCR;ELISA(CXCL10 等) | CXCL10 常用于肿瘤免疫场景中描述“免疫募集能力” |
| 负调控因子 | TREX1、USP18 等表达 | 限制通路、避免自身炎症的负反馈 | 实时定量 PCR;免疫印迹 | 放疗场景下 TREX1 上调可能“钝化”cGAS–STING 输出,值得单独监测 |
cGAS–STING 被激活的 DNA 来源很多:外源 DNA(病原体 / 转染)、内源 DNA(微核、线粒体 DNA 泄漏)、 放疗或化疗诱导 DNA 损伤等。Panel 设计建议围绕DNA 来源 + 模型类型来选,而不是把所有 ISGs 一次性测完。

图2. cGAS–STING 通路“指标 × 平台”匹配矩阵(自制示意图):用于快速选 panel,不涉及第三方版权。
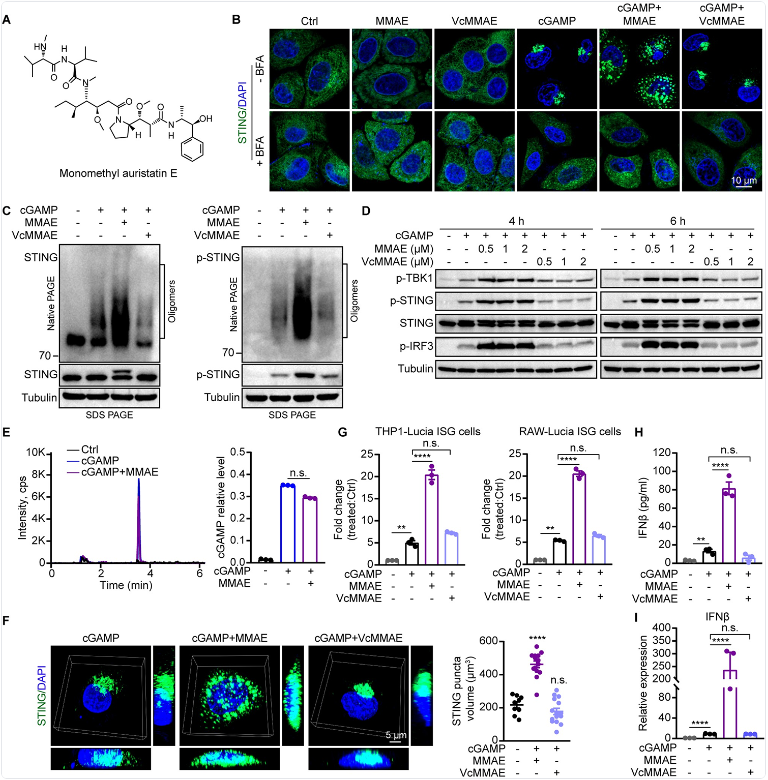
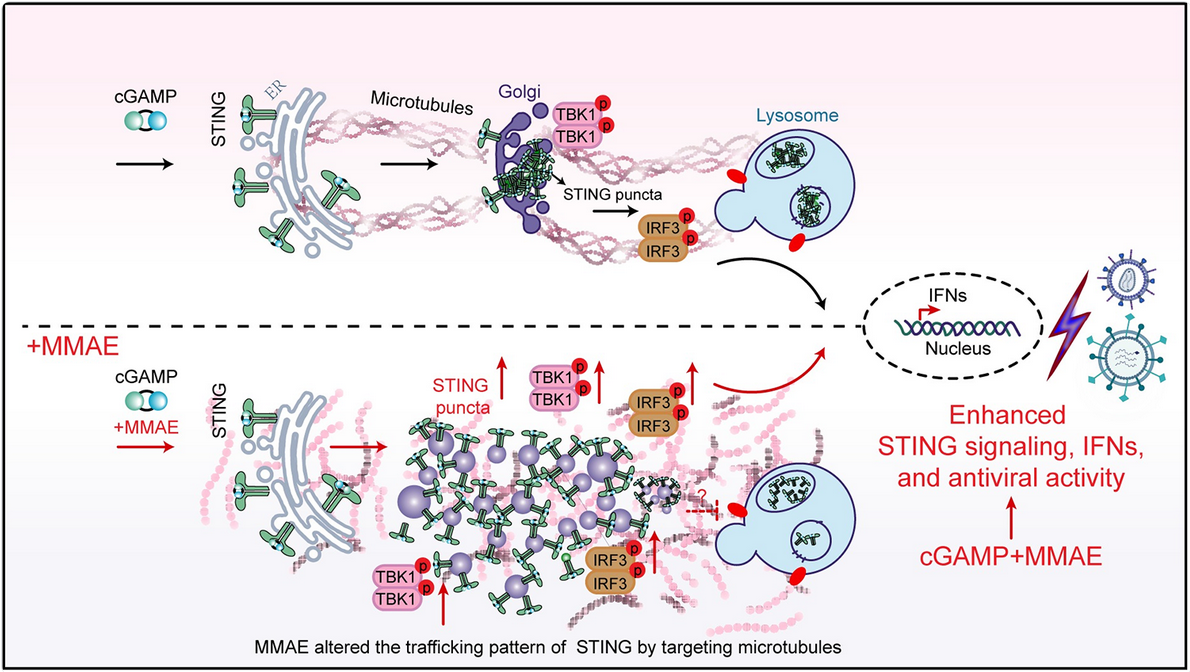
图3. STING 信号激活的代表性实验示例(含细胞成像与免疫印迹等面板)。 来源:Han 等,PLOS Pathogens(2024),Figure 4(开放获取,CC BY)。
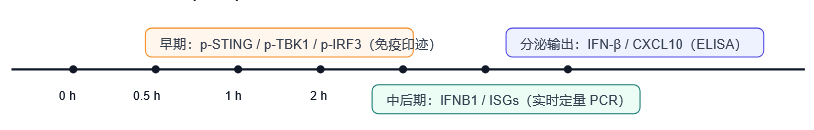
图4. 典型采样时间窗示意(自制):0.5–4 小时优先抓磷酸化 readout;4–8 小时更适合看 IFN-β/ISGs 输出。
如果只想用最少的指标覆盖 cGAS–STING 通路,建议优先考虑:
1、Ishikawa H, Ma Z, Barber GN. STING regulates intracellular DNA-mediated, type I interferon-dependent innate immunity. Nature. 2009;461(7265):788-792. DOI
2、Sun L, Wu J, Du F, Chen X, Chen ZJ. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway. Science. 2013;339(6121):786-791. DOI
3、Wu J, Sun L, Chen X, et al. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA. Science. 2013;339(6121):826-830. DOI
4、Ablasser A, Goldeck M, Cavlar T, et al. cGAS produces a 2′-5′-linked cyclic dinucleotide second messenger that activates STING. Nature. 2013;498(7454):380-384. DOI
5、Tanaka Y, Chen ZJ. STING specifies IRF3 phosphorylation by TBK1 in the cytosolic DNA signaling pathway. Science Signaling. 2012;5(214):ra20. DOI
6、Konno H, Konno K, Barber GN. Cyclic dinucleotides trigger ULK1 (ATG1) phosphorylation of STING to prevent sustained innate immune signaling. Cell. 2013;155(3):688-698. DOI
7、Motwani M, Pesiridis S, Fitzgerald KA. DNA sensing by the cGAS–STING pathway in health and disease. Nature Reviews Genetics. 2019;20(11):657-674. DOI
8、Hopfner K-P, Hornung V. Molecular mechanisms and cellular functions of cGAS–STING signalling. Nature Reviews Molecular Cell Biology. 2020;21(9):501-521. DOI
返回顶部