
2025年9月3日,汉堡大学结构系统生物学中心的研究团队在《Nature》杂志发表论文《A nanobody specific to prefusion glycoprotein B neutralizes HSV-1 and HSV-2》。研究首次分离出针对疱疹病毒糖蛋白B(gB)融合前(prefusion)构象的特异性纳米抗体Nb1_gbHSV,该抗体具有强中和活性(IC50=1.2 nM)和跨物种(HSV-1/2)效果,并通过cryo-EM解析了HSV-1/2 gB的全长高分辨率结构,揭示了膜融合机制的关键细节,为疱疹病毒疫苗和抗病毒疗法的开发提供了新靶点和策略。
人类疱疹病毒家族包括9种病毒(如HSV-1、HSV-2、人巨细胞病毒等),这些病毒导致从口腔/生殖器疱疹到新生儿感染和癌症等多种疾病。病毒包膜上的糖蛋白 B(gB)是病毒入侵宿主细胞的关键 —— 作为所有疱疹病毒中最保守的糖蛋白,gB 需从融合前构象经剧烈构象重排转变为融合后构象,才能完成膜融合过程,助力病毒进入细胞。然而,gB 的融合前构象极不稳定(亚稳态),难以通过结构解析捕获,导致长期缺乏针对该构象的中和抗体与靶向药物。
研究团队创新采用gB 囊泡免疫羊驼(避免gB 脱离膜后不可逆转为融合后构象),通过噬菌体展示技术构建免疫文库,最终从 17 个候选纳米抗体中筛选出 Nb1_gbHSV。该纳米抗体在 HSV-1 空斑减少实验中表现出优异的中和活性,半数抑制浓度(IC??)低至 1.2 nM(图 1b),远优于多数传统单克隆抗体;微尺度热泳动(MST)实验显示,其与融合前 gB 的解离常数(K_D)约为 14 pM,对融合后 gB 无结合活性,体现出极强的融合前特异性;同时,因 HSV-1 与 HSV-2 的 gB 表位高度保守,Nb1_gbHSV 可通过荧光共定位实验证实能同时结合两种病毒的 gB,但不识别水痘 - 带状疱疹病毒(VZV)、人巨细胞病毒(HCMV)等其他疱疹病毒的 gB,具备跨物种识别能力。
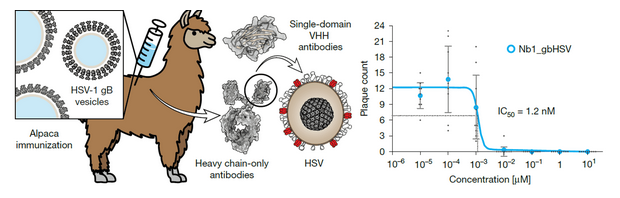
图 1. 抗gB纳米抗体的生成和靶点稳定化
为捕获 gB 的融合前构象,研究团队基于此前HSV-1 gB模型的认知,设计了多组稳定突变,包括可锁定融合前构象中邻近结构域以阻止分离的二硫键突变,以及能增强中央螺旋疏水性相互作用以抑制构象重排的螺旋稳定突变。借助冷冻电镜技术,成功解析出融合前 gB 的 2.74 ? 高分辨率结构,对比融合后构象(PDB 5V2S),发现 gB 核心结构域存在三大关键重排差异:一是 N 端残基 90-106 形成螺旋,嵌入相邻原体 DI-DII 凹槽,通过疏水作用与盐桥稳定;二是 DIII 中央螺旋(αC)N 端残基 501-510 融合前呈环状、融合后延伸为长螺旋,且 DII 的 αX 螺旋融合前直立以避空间冲突、融合后平卧;三是 DI 顶端融合环融合前 “卷起” 为短 3??螺旋(结合 MPR 疏水凹槽并形成氢键)、融合后完全伸展,二者转变是膜融合启动的关键。
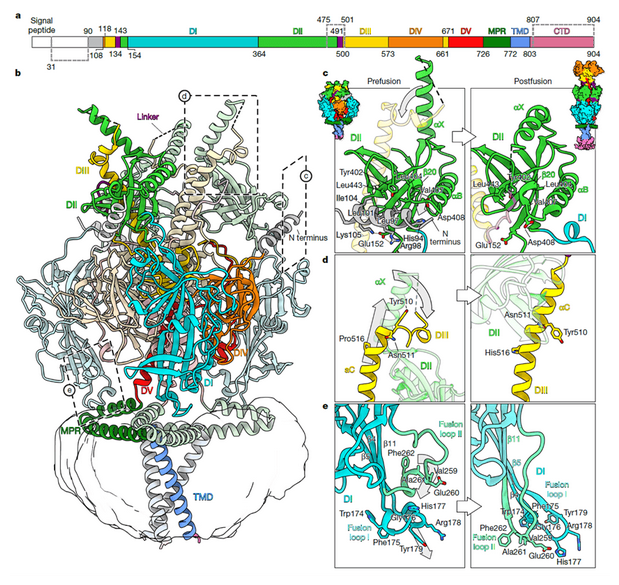
图 2. 全长预融合结构的gB
通过冷冻电镜解析 Nb1_gbHSV 与融合前 gB 形成的复合物(3 ? 分辨率),研究发现 Nb1_gbHSV 的结合表位具有跨域特性,它可同时结合 gB 的结构域IV(DIV)、相邻原体的结构域I(DI)与结构域 III(DIII),覆盖1260 ?2 的埋藏表面积,并形成 23 个氢键与 8 个盐桥;由于在融合前构象中 DI 与 DIV 邻近,而融合后构象中二者分离,Nb1_gbHSV 的跨域结合会与融合后构象产生严重空间冲突,从而强制 gB 维持融合前状态,阻断膜融合必需的构象重排,清晰阐明了其中和机制;此外,研究还通过光栅耦合干涉法检测发现 3 种 “融合前特异性但无中和活性” 的纳米抗体,它们仅结合 gB 顶端的 αX 螺旋,证明 “融合前特异性” 并不等同于 “中和活性”,纳米抗体需同时满足“高亲和力 + 跨关键结构域表位”两个条件才能实现中和作用。
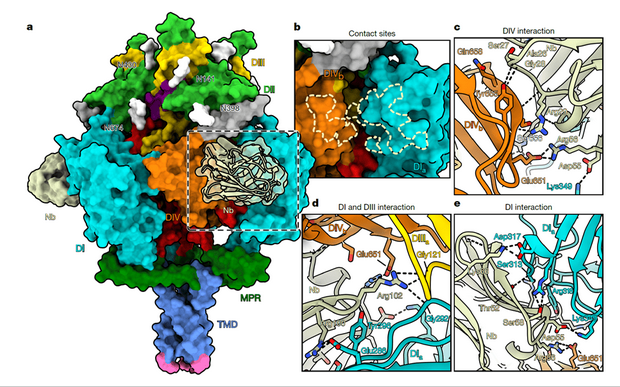
图 3. Nb1_gbHSV结合gB构象
为验证中和机制的普适性,研究团队通过共表达Nb1_gbHSV与野生型HSV-2 gB,在稳定转导的 HEK 293T 细胞中纯化蛋白并经冷冻电镜解析,首次获得 HSV-2 gB 的融合前(2.85 ?)与融合后(2.26 ?)结构;结果显示 HSV-2 gB 的融合前构象与 HSV-1 高度相似,其 N 端螺旋(残基 90-106)与 DII的相互作用、αX 螺旋的直立排列等特征均与 HSV-1 gB 一致,且 Nb1_gbHSV 在 HSV-2 gB 上的结合模式完全保守,仅在 HSV-2 gB 的融合前构象中能检测到 Nb1_gbHSV 的结合信号,证实 Nb1_gbHSV 可强制野生型 HSV-2 gB 维持融合前状态,进一步验证了 “构象锁定” 这一中和机制的普适性,也为针对 HSV-2 感染的防治提供了结构与机制支持。
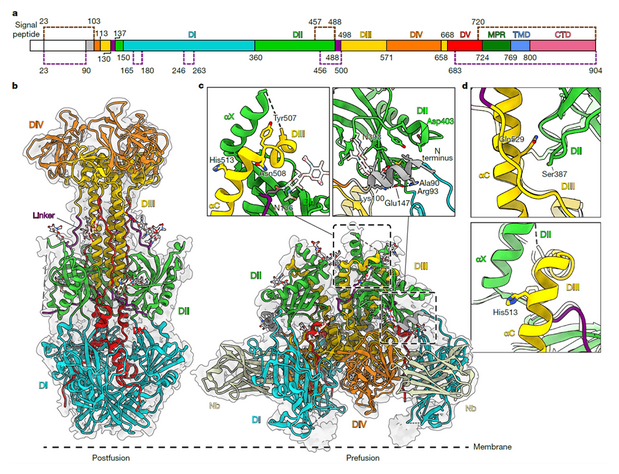
图 4. HSV-2的gB被Nb1_gbHSV结合
gB 蛋白是疱疹病毒 “不可替代” 的靶点,其功能突变会导致病毒失活,融合前构象的跨结构域表位(如 Nb1_gbHSV 识别的结构域 I - 结构域 III - 结构域 IV 区域)是中和干预的关键位点,不易因病毒突变产生耐药性,极具研究与应用价值,Nb1_gbHSV 是目前最具潜力的 gB 靶向工具:在基础研究中,它可作为 “构象探针” 捕获活病毒或细胞表面的融合前 gB,助力研究病毒入侵动力学;在临床转化方面,相较于传统单克隆抗体,其分子量小(约 15 kDa)、组织穿透性强,还可通过基因工程改造增强半衰期或多价结合能力,进一步提升中和活性,未来应用前景广阔。
abinScience 品牌创立于法国斯特拉斯堡,依托该地区卓越的科研创新生态,专注于高质量生命科学试剂的研发与生产。abinScience始终秉持“Empowering Bioscience Discovery”的愿景,致力于为全球科研人员提供高效、可靠的实验解决方案,赋能前沿生命科学研究。上述研究中展现出卓越性能的 Nb1_gbHSV,abinScience 也提供针对性的产品,作为可直接应用的科研工具,助力推动 HSV 入侵机制研究、抗病毒药物筛选、融合前 gB 靶向疫苗开发等领域的高效开展,为疱疹病毒相关研究提供可靠支撑。
以下为 abinScience 提供的相关蛋白与抗体产品清单:
| Catalog No. | Product Name |
| VK006043 | Anti-HSV Glycoprotein B/gB Nanobody (Nb1_gbHSV) |
| VK006053 | Anti-HSV Glycoprotein B/gB Antibody (Nb1_gbHSV) |
返回顶部