
在流式细胞术实验中,非特异性染色引发的高背景荧光,是制约数据精准性的高频痛点。它不仅会模糊阳性与阴性群体的界限,降低信噪比,更可能导致实验结论误判,使科研人员在反复调试中耗费大量时间与精力。
这类看似复杂的高背景问题,往往并非由单一因素导致,而是实验场景、样本特性与操作细节共同作用的结果。想要高效解决这一问题,关键在于厘清实验核心逻辑,识别易被忽视的隐性干扰因素,并结合针对性的定位方法与实操策略,才能建立清晰、可复现的优化路径。
在非特异性染色导致的高背景问题中,许多干扰源自看似合理的“常规操作”。精准识别并解析这些误区,是高背景排查的首要环节,有助于避免盲目调参,快速锁定问题本质。
![]()
Fc阻断剂的核心作用,是抑制抗体Fc段与细胞表面Fc受体之间的特异性结合。但这一策略并非对所有非特异性染色均有效,尤其在髓系细胞样本中,常可观察到Fc阻断后背景信号仍然显著存在的情况。
花青素类染料(如Cy5及其串联染料)在单核细胞、巨噬细胞和树突状细胞中,常表现出Fc非依赖性的背景信号升高。该现象在Fc受体充分阻断后仍可观察到,提示其并非典型的Fc介导结合过程。
目前,该现象的具体分子机制尚未完全阐明。既往研究中有推测认为,花青素荧光团可能与髓系细胞表面高度表达的Fcγ受体(如CD64)或其他膜相关结构发生Fc非依赖性的相互作用。然而,更广泛的实验观察表明,这类背景信号具有显著的染料依赖性:在相同抗体、相同细胞条件下,更换为非花青素类荧光素(如APC、Alexa Fluor 647)后,背景可明显降低。
这一结果提示,该现象更可能反映的是花青素类荧光团自身理化特性(如较强疏水性)与髓系细胞膜结构之间的非特异性相互作用,而非由单一受体分子主导。
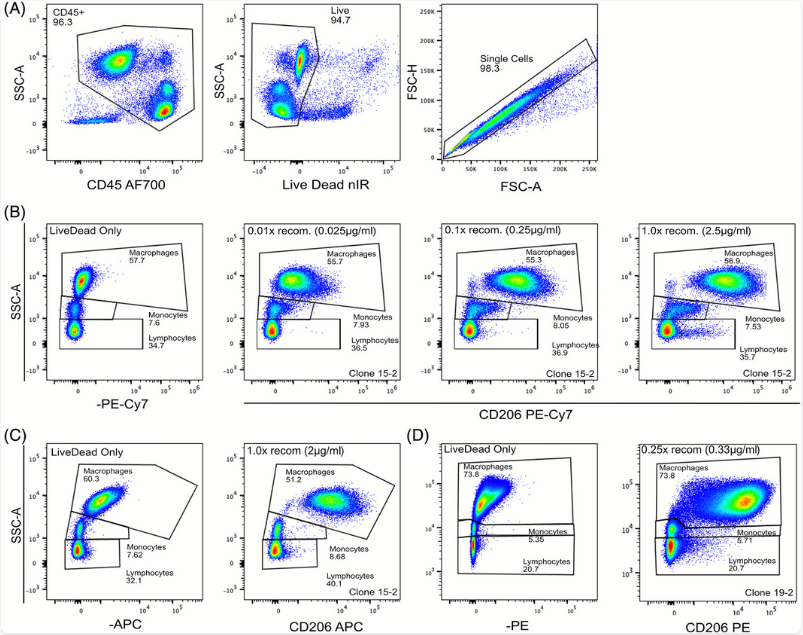
图1. Fc受体阻断后,PE-Cy7标记的CD206在淋巴细胞与单核细胞中仍出现明显非特异性染色(图B);更换为APC或PE标记后,背景显著降低(图C)。(图片来源:DOI: 10.1002/cyto.a.24273)
注:Fc阻断仍属必要步骤,但需明确其作用边界,避免过度依赖。
![]()
同型对照的核心价值在于评估抗体Fc段介导的非特异性结合及部分胞内交叉反应。然而,在多色实验中,过度依赖同型对照不仅增加操作复杂度,还可能因关键参数不匹配而误导结果判断。
关键问题
不同厂家、不同批次抗体的荧光素–蛋白(F:P)比例差异显著。例如,A公司CD4-PE抗体的F:P为2:1,而B公司同型对照抗体的F:P为4:1,即便使用相同抗体量,同型对照的荧光强度也可能显著偏高,从而被误判为“目标抗体背景过高”。
优化方案
![]()
误区解析
电压调节的核心目标,是在保证动态范围的前提下最大化群体分辨率,而非单纯压低背景。电压设置过低,往往会压缩低表达抗原的信号分布,使阳性群体与背景界限反而更加模糊。
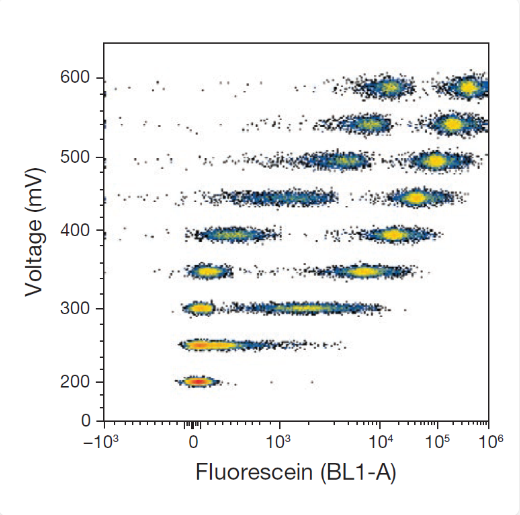
图2. 电压对荧光素分辨率的影响
在排除常见操作误区后,若背景荧光仍未显著改善,需进入进阶排查阶段,重点关注在特定样本或实验条件下高频出现的隐性成因。
![]()
在PMA活化PBMC或细胞因子刺激实验中,常可观察到多个通道背景同步升高。这一现象通常并非抗体或染料质量问题,而是细胞代谢状态变化的结果。
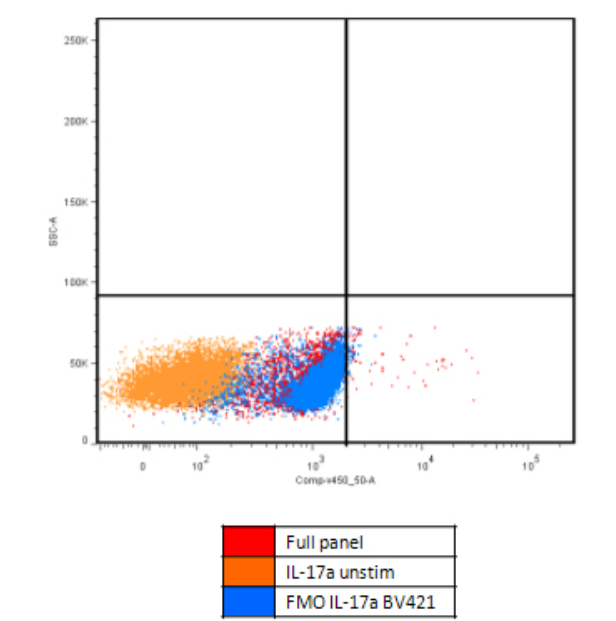
图3. PMA活化的PBMC中检测IL-17A,从FMO对照中明显看出BV421通道基线的上升(图片来源:流式中文网)
细胞代谢活化后,胞内NADH、黄素辅酶等内源性荧光分子水平升高,自发荧光增强;同时细胞膜通透性增加,放大荧光渗漏效应,导致整体基线抬高。
![]()
胞内染色背景升高,常源于固定与破膜条件不匹配,而非抗体特异性不足。
——从“现象判断”回到“机制定位”的实操闭环
在完成前述误区排查与隐性成因分析后,高背景问题的处理应回归到一个核心原则:先判断背景信号的来源属性,再选择对应的干预手段,而非直接进行经验性调整。
基于非特异性染色最常见的发生机制,可将高背景问题拆解为以下四类来源,并据此构建一条由浅入深、可快速定位的问题排查路径。
1. 高背景快速排查路径(机制导向型)
(1)判断背景是否与死细胞/碎片相关(样本状态层面)
判定逻辑
若高背景主要集中于死细胞或碎片区域,则其本质通常为:抗体或荧光素在膜完整性受损细胞中的非特异性渗透或吸附,而非抗原特异性问题。
图4. 死细胞的非特异性染色结果
优先从样本质量与死细胞排除入手,而非调整抗体或补偿参数。
(2)核查FMO对照,定位是否为荧光素相关背景
若FMO对照中某通道背景显著升高,提示问题更可能来源于:荧光素自身特性(如光谱渗漏、染料-细胞非特异性相互作用),而非抗体特异性。
聚焦于荧光素选择、电压设置及染色条件优化,而非简单降低抗体用量。
(3)进行“荧光素替换验证”,区分抗体问题与染料问题
若更换为非花青素类染料(如APC、Alexa Fluor 647)后背景显著下降,则可基本确认问题源于染料–细胞非特异性相互作用,在髓系细胞样本中尤为常见。
(4)复盘固定/破膜流程(胞内染色专属)
若仅胞内染色背景升高,且FMO同样抬高,问题多与固定/破膜条件不匹配有关,而非抗体特异性不足。
![]()
| 实验场景 | 主要背景来源 | 机制层面解释 | 针对性优化策略 |
| 多色实验(≥6色) | 荧光渗漏叠加 | 光谱重叠放大基线噪声 | ①优化荧光素组合;②单独滴定每个抗体后再组合染色 |
| 髓系细胞染色 | 自发荧光+染料依赖性非特异结合 | 花青素类染料与髓系细胞膜结构发生非特异相互作用 | ①避免使用Cy5/PE-Cy5等花青素染料;②染色缓冲液中加入1–2 %BSA;③使用商业化的花青素封闭剂 |
| 活化/刺激后样本 | 内源性荧光增强 | 代谢活化导致自发荧光与膜通透性升高 | ①增加洗涤次数;②下调抗体浓度;③选择长波长荧光素 |
| 胞内转录因子染色 | 固定/破膜引发非特异结合 | 蛋白过度交联或胞内位点暴露 | ①固定/破膜方案与抗原类型匹配;②破膜后进行蛋白封闭 |
| 死细胞/碎片比例高 | 抗体非特异渗透 | 膜完整性丧失导致假阳性 | ①过滤样本;②加入EDTA;③活性染料+散射光双重设门 |
流式高背景问题的解决,核心在于建立“误区排查—成因定位—实操优化”的完整逻辑链。非特异性染色引发的背景升高,并非偶发异常,而是可被系统识别和有效控制的实验变量。
通过对常见误区、隐性成因及分场景策略的系统梳理,可显著提升高背景问题的定位效率与优化成功率,为流式数据的可靠性提供坚实保障。
abinScience创立于法国,专注于高质量生命科学试剂的开发与生产,立足法国斯特拉斯堡创新科技中心,以“Empowering Bioscience Discovery”为愿景。
abinScience流式抗体产品覆盖常用检测指标,品类丰富,可满足多物种(Human/Mouse/Rat/Dog/Hamster/Monkey等)科研实验需求,为科研提供稳定可靠的支持。
返回顶部