
强直性脊柱炎(Ankylosing Spondylitis,AS)是一种主要影响中轴骨骼的慢性炎症性疾病。然而,在现代科研中,AS早已不再被单纯视为‘关节炎’或仅由单一炎症因素引发的疾病模型。大量研究表明,其核心病理过程涉及免疫调控失衡、慢性炎症持续以及异常成骨信号的相互耦合,这些过程共同决定了疾病的发生、进展及不可逆的结构损伤。
因此,AS研究的关键问题并不止于“炎症是否存在”,而在于:炎症是如何被启动并长期维持的,它为何在特定组织中具有选择性,以及这种免疫异常如何最终转化为结构性改变。围绕这些问题展开的机制研究,构成了当前AS科研的主线。
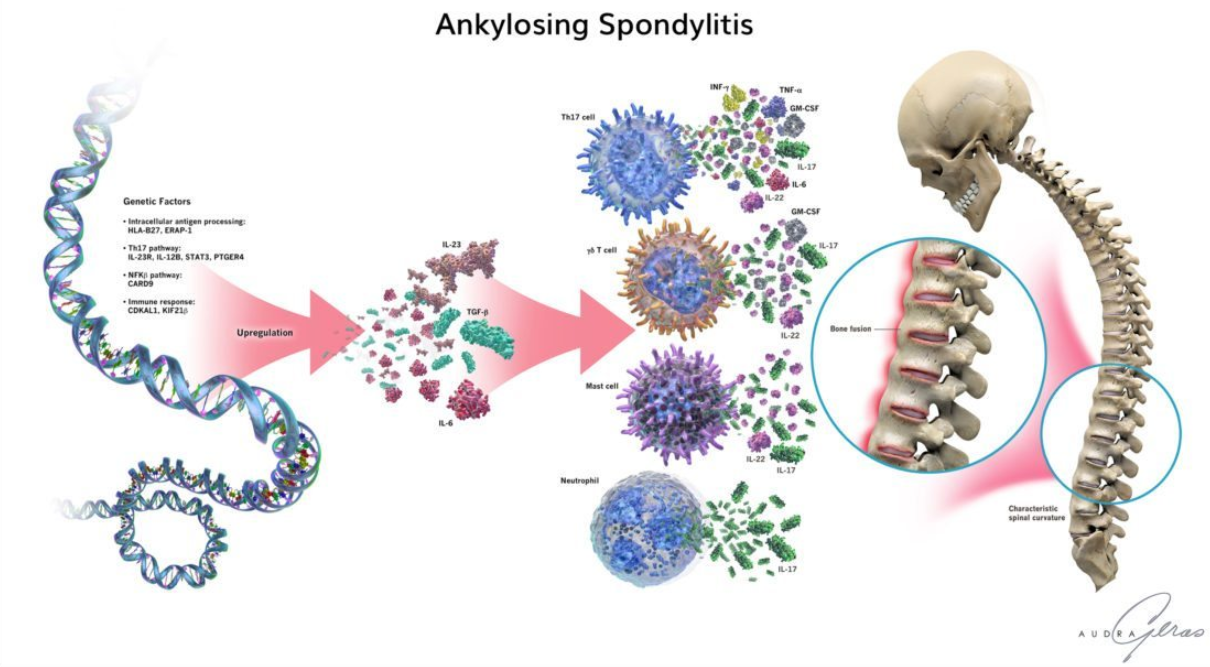
图1. 强直性脊柱炎
早期关于AS 的研究,主要围绕TNF-α 等经典炎症因子展开。TNF 抑制剂在临床上的成功应用,不仅显著改善了患者症状,也在很长一段时间内强化了“AS 是典型炎症性疾病”的认识。然而,随着长期随访数据的积累,这一模型逐渐暴露出局限性。
一方面,并非所有患者都能对TNF 抑制产生充分反应;另一方面,即便炎症指标得到有效控制,部分患者仍持续出现影像学进展和新骨形成。这提示AS 中的炎症并非孤立事件,而是嵌入在一个更复杂的免疫调控网络之中。由此,研究重点逐渐从单一炎症因子的阻断,转向多通路协同失衡的免疫网络结构,以及这些通路如何共同维持疾病活动。
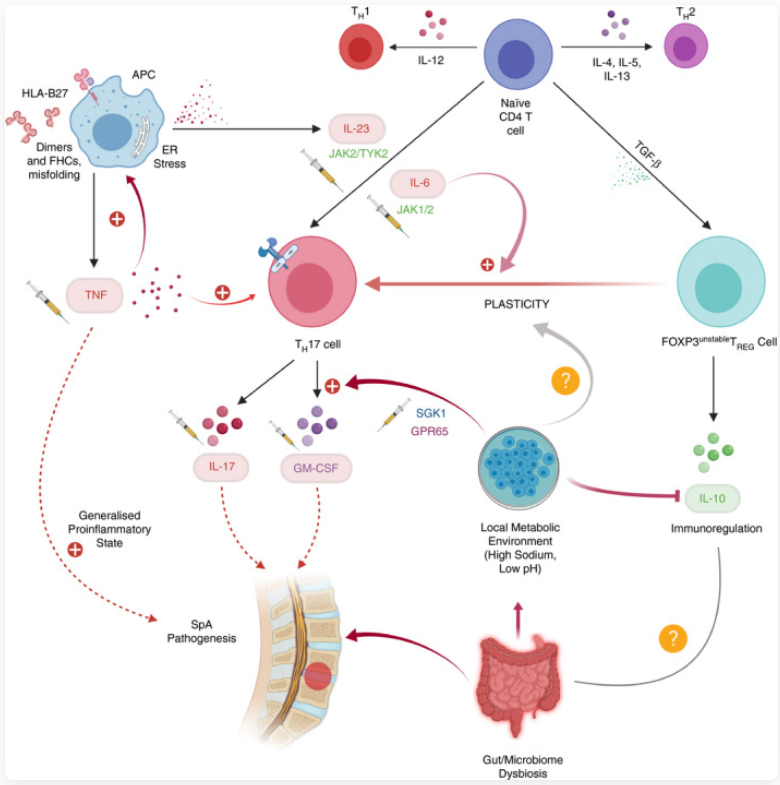
图2. 炎症机制与强直性脊柱炎
在这一免疫网络中,IL-23/IL-17 轴长期被认为是AS 最具代表性的关键信号通路。该轴线与AS 的遗传背景、免疫细胞活化状态以及临床干预效果之间均存在高度关联,使其在相当长时间内成为研究和治疗的中心。
然而,随着针对该通路的临床研究不断推进,一个重要矛盾逐渐显现:IL-17 抑制策略在AS 中显示出稳定疗效,而IL-23 抑制却多次未能取得预期结果。这一现象无法用传统的“IL-23驱动Th17—IL-17致炎”模型加以解释,也迫使研究者重新思考IL-17 在AS 中的真实来源及其调控方式。
正是在这一背景下,IL-23/IL-17 轴不再被简单视为一条线性通路,而成为重新理解AS免疫异质性的切入点。
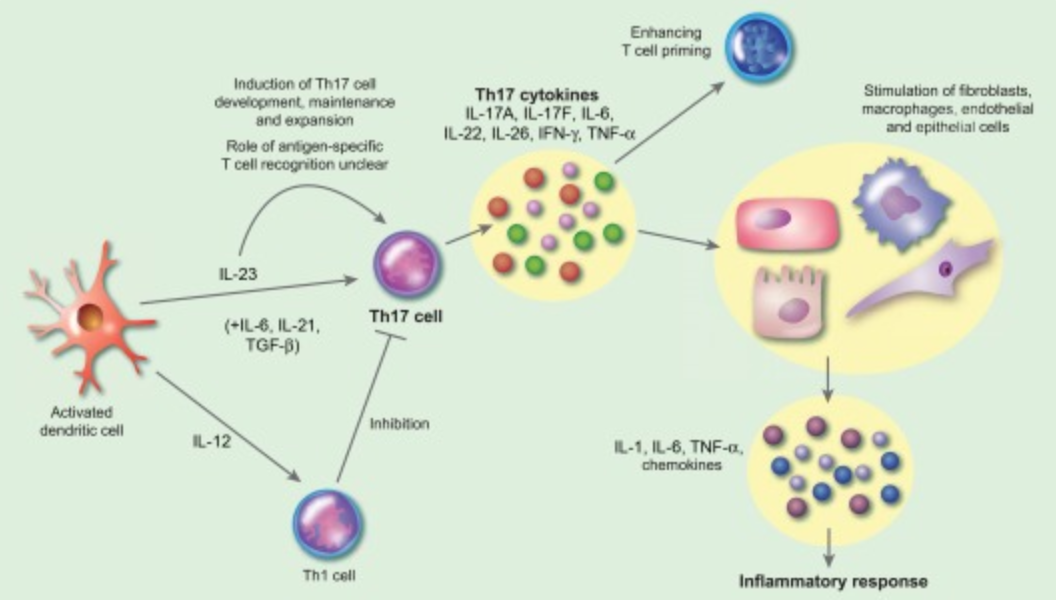
图3. Interleukin (IL)‐17/IL‐23 pathway
针对上述矛盾,近年来的研究逐渐将视角从经典Th17 细胞,拓展至一类具有先天免疫特征的IL-17 产生细胞群体,包括γδT 细胞、ILC3 和MAIT 细胞等。这些细胞在功能上与传统Th17 细胞存在显著差异,它们能够在较弱甚至缺乏IL-23 信号的情况下直接产生IL-17 。
更为关键的是,这类细胞并非主要存在于外周血中,而是倾向于分布在组织局部,尤其是AS 特征性病变相关的附着点区域。这一空间分布特征,与AS 的组织病理学表现高度一致,也提示AS 中的关键免疫事件可能主要发生在特定组织微环境,而非系统性免疫循环中。
这一认识不仅为IL-23 靶向治疗效果不佳提供了机制层面的解释,也推动AS 研究从传统的外周免疫分析,转向组织免疫调控和局部炎症维持机制。
在TNF-α 不再被视为仅有的核心炎症因子的背景下,研究者开始关注:在TNF 信号受到抑制后,哪些机制仍能够维持AS 的炎症状态。
这一问题引出了多条新的研究方向。JAK/STAT 通路作为多种细胞因子信号的整合枢纽,被认为在炎症信号放大和持续中发挥重要作用;趋化因子及其受体轴(如CCL20–CCR6)则被发现与炎症细胞在组织中的定向迁移和滞留密切相关。此外,IL-6、IL-1 家族等炎症协同因子虽然单独靶向效果有限,但在慢性炎症环境中可能通过网络化协同维持免疫激活状态。
这一阶段的研究重点,已经从“炎症强度的调控”,转向炎症持续性的机制基础。
相比炎症机制,病理性成骨仍然是AS 研究中最具挑战性的领域之一。临床实践反复证明,抑制炎症可以显著改善症状,却难以同步阻断新骨形成,这一现象提示炎症与成骨之间并非简单的因果关系。
当前研究逐渐形成共识:炎症更可能通过改变局部微环境,间接影响成骨相关信号通路。例如,Wnt/β-catenin和BMP 通路在AS 中的异常激活,可能并非由炎症强度直接决定,而是受到组织特异性信号整合和时间窗口的调控。在这一模型中,炎症并非成骨的直接触发因素,而是通过“重编程”局部微环境,为异常骨生成创造条件。
这一思路正在推动 AS 研究从“炎症之后发生了什么”,转向“炎症如何塑造成骨发生的条件”。
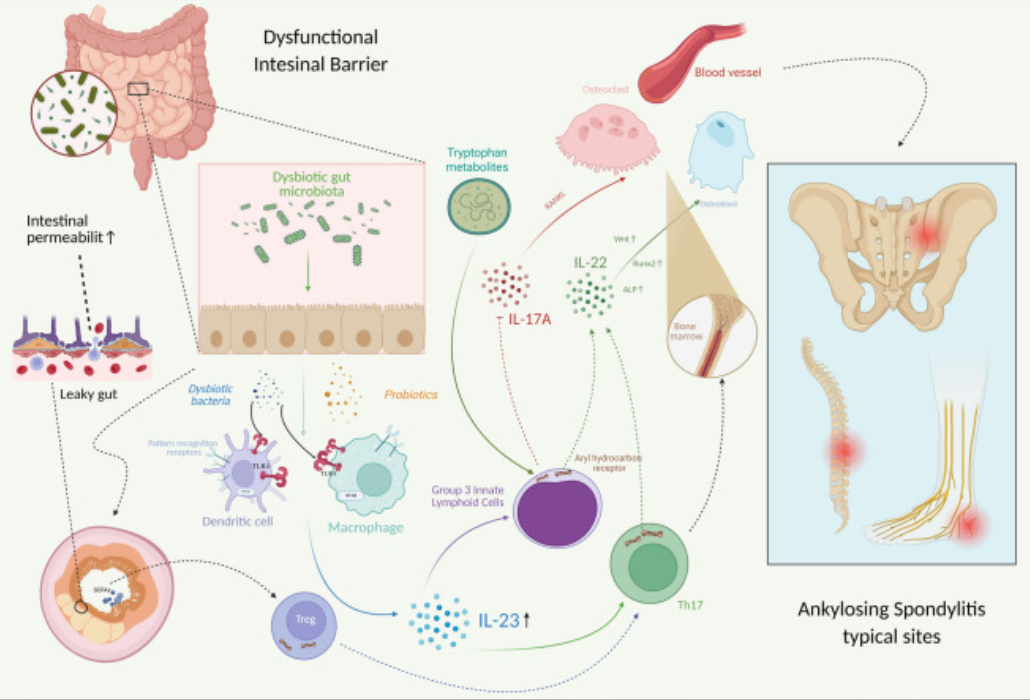
图4. Mechanistic Overview of the Gut-Bone Axis in AS
近年来,AS研究的另一个显著变化,是研究视角和研究材料的转移。越来越多的工作开始关注附着点、骶髂关节及脊柱相关组织中的免疫细胞组成,而不再仅依赖外周血指标。
与此同时,“肠道—关节轴”逐渐成为活跃研究方向。部分AS患者存在隐匿性肠道炎症,肠道免疫异常可能通过免疫细胞迁移和炎症信号传递,参与关节局部炎症的维持。这一发现进一步拓展了AS的研究边界,使其逐渐融合免疫学、组织生物学和微生态学等多个领域。
总体来看,当前强直性脊柱炎的科研重点,已经从单一炎症靶点的探索,转向对免疫网络、组织微环境以及病理性成骨机制的系统性解析。
IL-23/IL-17轴仍然是研究核心,但关注点已从经典Th17细胞扩展至多种先天样免疫细胞;TNF-α不再是仅有焦点,多通路协同调控逐渐成为共识;而炎症与成骨之间的耦合机制,仍是决定疾病长期结构进展的关键科学问题。
对于科研人员而言,AS不再只是一个“炎症性疾病模型”,而是一个连接免疫调控、组织特异性炎症和骨生物学的复杂研究体系,其研究深度和广度仍在持续拓展。
| 产品名称(Product name) | 目录号(Catalog No.) |
| InVivoMAb Anti-Human TNFa/TNF-alpha (Iv0050) | HF879010 |
| InVivoMAb Anti-Human IL1B/IL1F2 (Iv0019) | HF943010 |
| InVivoMAb Anti-Human BMP2 (Iv0058) | HY576010 |
| Mouse Anti-Human BMP2 Antibody (Iv0058) | HY576023 |
| Anti-IL17A Polyclonal Antibody | HS856014 |
| Anti-Human CD127/IL7R Antibody (MD-707) | HB016107 |
| Anti-Human IL12A/IL-12 p35/NKSF1 Antibody (SAA0380) | HB936107 |
| Anti-Human BMP2 Antibody (SAA0423) | HY576107 |
| Anti-MAPK1 Polyclonal Antibody | HB229014 |
| Anti-JAK1 Polyclonal Antibody | HB829014 |
| Anti-IL1B/IL1F2 Polyclonal Antibody | HF943014 |
| 作用靶点 | 产品名称(Product name) | 目录号(Catalog No.) |
| IL-17A | Ixekizumab ELISA Kit | DS856038 |
| Secukinumab ELISA Kit | DS856058 | |
| Vunakizumab ELISA Kit | DS856078 | |
| TNF-α | Certolizumab ELISA Kit | DF879028 |
| Etanercept ELISA Kit | DF879058 | |
| Adalimumab ELISA Kit | DF879018 | |
| Golimumab ELISA Kit | DF879038 | |
| Infliximab ELISA Kit | DF879048 | |
| IL-1β | Canakinumab ELISA Kit | DF943018 |
| Gevokizumab ELISA Kit | DF943028 |
| 作用靶点 | 产品名称(Product name) | 目录号(Catalog No.) |
| CD127/IL7R | Research Grade Anti-Human CD127/IL7R (GSK2618960) | HB016046 |
| Research Grade Crebankitug | HB016056 | |
| Research Grade Bempikibart | HB016026 | |
| IL1B/IL1F2 | Research Grade firsekibart | HF943096 |
| Research Grade Anti-Human IL1B/IL1F2 (DLX2323) | HF943056 | |
| Research Grade Anti-Human IL1B/IL1F2 (SK48-E26) | HF943086 | |
| IL17A | Research Grade Secukinumab | HS856026 |
| Research Grade betinukibart | HS856236 | |
| Research Grade turenkibart | HS856246 | |
| Research Grade Anti-Human IL17A Antibody (XAB4) | HS856196 | |
| TNF-α | Research Grade Adalimumab | HF879026 |
| Research Grade Anti-Human TNFa/TNF-alpha Antibody (hMAK195) | HF879406 | |
| Research Grade Etanercept | HF879296 |
abinScience 高质量科研工具为解析免疫网络失衡的分子机制、探索炎症与病理性成骨的耦合关联,推进 AS 相关诊断技术与治疗药物的研发提供可靠支持,助力科研人员深入挖掘疾病核心科学机制,加速 AS 领域基础研究进程,推动相关学术探索的深度拓展与创新突破。
更多关于强直性脊柱炎研究产品欢迎扫码咨询或发邮件给我们:support@abinscience.com
[1]Voruganti A,
Bowness P. New developments in our understanding of ankylosing
spondylitis pathogenesis. Immunology. 2020 Oct;161(2):94-102. doi:
10.1111/imm.13242. Epub 2020 Aug 17. PMID: 32696457; PMCID: PMC7496782.
[2]
Xi Y, Jiang T, Chaurasiya B, Zhou Y, Yu J, Wen J, Shen Y, Ye X, Webster
TJ. Advances in nanomedicine for the treatment of ankylosing
spondylitis. Int J Nanomedicine. 2019 Oct 29;14:8521-8542. doi:
10.2147/IJN.S216199. PMID: 31806960; PMCID: PMC6831987.
[3]
Jethwa H, Bowness P. The interleukin (IL)-23/IL-17 axis in ankylosing
spondylitis: new advances and potentials for treatment. Clin Exp
Immunol. 2016 Jan;183(1):30-6. doi: 10.1111/cei.12670. Epub 2015 Sep 30.
PMID: 26080615; PMCID: PMC4687521.
[4]
Zhang X, Jia L, Lin X, Zhou L. The gut-bone axis in ankylosing
spondylitis: mechanistic insights and the translational gap. Clin Exp
Med. 2025 Nov 18;26(1):12. doi: 10.1007/s10238-025-01939-x. PMID:
41249613; PMCID: PMC12628479.
[5]
Boengiu CA, Barbulescu AL, Dragomirescu CC, Buga AM, Mirea AA. Linking
AIM2 Inflammasome Activation, Mitochondrial Dysfunction and Chronic
Inflammation in Ankylosing Spondylitis. Cells. 2025 Dec 3;14(23):1923.
doi: 10.3390/cells14231923. PMID: 41369412; PMCID: PMC12691365.
返回顶部