
一、外泌体介绍
外泌体(Exosomes)是细胞分泌到胞外的一种纳米级囊泡(Extracellular Vesicles,EVs),其大小仅30-150nm,大小与某些病毒接近,但不具备自主复制能力,本质上是细胞分泌的囊泡。它们如同细胞派出的 “纳米信使” ,具有双层膜结构,内部装载着丰富的“信息”(包括核酸、蛋白和脂质等),在细胞之间穿梭,精准地参与细胞间的分子传递与通信。
2013年,诺贝尔生理学或医学奖授予了美国科学家詹姆斯·罗思曼、兰迪·谢克曼及德国科学家托马斯·祖德霍夫,表彰他们在细胞间囊泡运输调控机制领域作出突出贡献,将外泌体研究的热度推向高潮。
外泌体(Exosome)是由大多数细胞分泌的小膜泡。内泡由细胞室向内出芽形成,称为多泡体(MVB)。当MVB与质膜融合时,这些内部的囊泡被释放为外泌体,外泌体可以将DNA、RNA和蛋白质转移到远处的受体细胞,并影响细胞行为和生理的各个方面。
外泌体广泛存在于细胞培养上清以及各种体液中,包括血液、淋巴液、唾液、尿液、精液、乳汁等,同时也存在于组织样本中,如脑组织、肌肉组织、脂肪组织等。
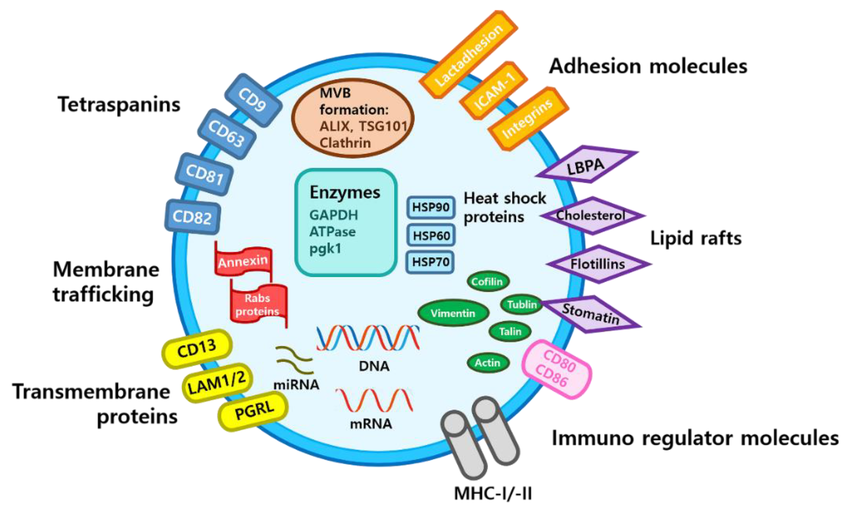
图1. 外泌体结构展示(DOI:10.3390/biology10040285)
二、流式细胞术检测外泌体
由于外泌体的纳米级尺寸超出了传统流式细胞仪的光学检测极限,因此需要特殊策略对其进行有效检测。目前主流方法如下:
1.微球捕获放大检测
在微球上预包被外泌体特异性抗体(如:CD9、CD63、CD81等),再使用微球进行外泌体的捕获,捕获后与带荧光标记的二抗(针对另一个外泌体表面抗原或针对一抗的种属)结合,最后通过流式细胞仪检测,从而来反映外泌体的情况。这样的好处在于可以精准的检测出外泌体,并且适用于大部分流式细胞仪。
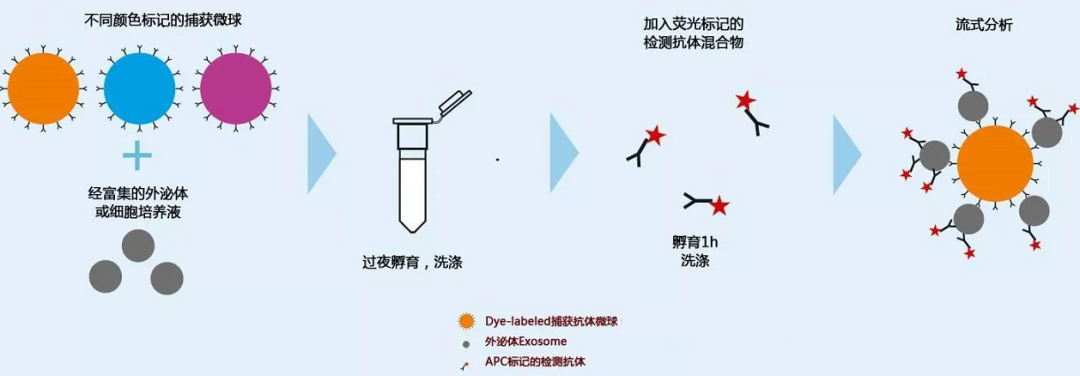
图2:微球检测外泌体实验原理
2. 纳米流式检测法
一些高精度流式细胞仪(如:Beckman的CytoFLEX nano 纳米流式分析仪、ApogeeFlow 的MicroPLUS / Micro等)可以直接检测外泌体。这些仪器在传统流式的基础上把光学、探测器和软件做高灵敏度优化,使仪器能对几十到几百纳米的单个纳米颗粒(如外泌体)产生可测的散射或荧光信号,从而实现单颗粒计数、大小估算与表面标志物检测。
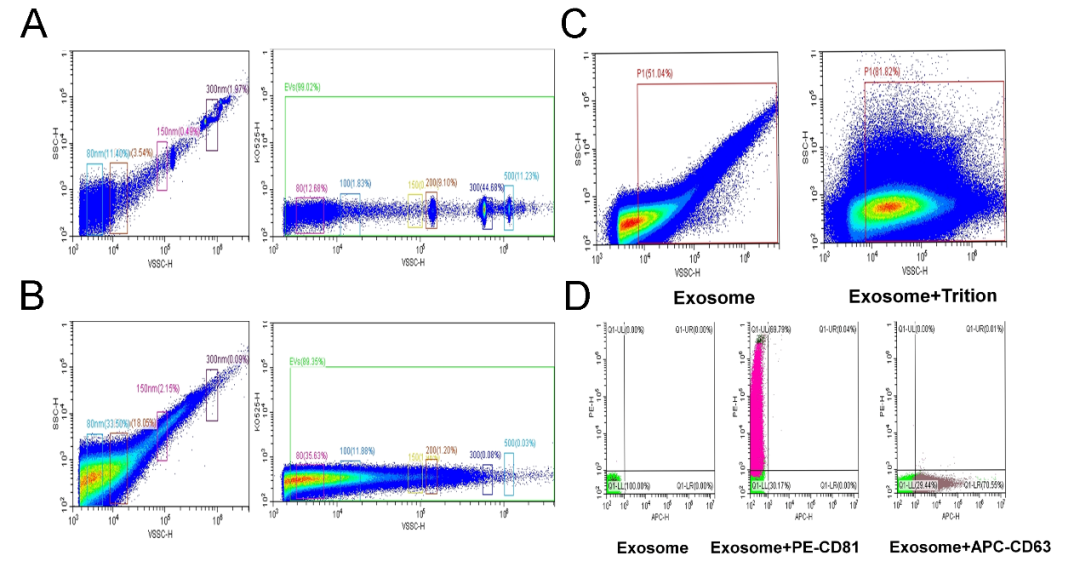
图3. 流式细胞术鉴定粒径和外泌体表面标志蛋白(图片来源:Beckman官网)
A. 标准化微球进行仪器校准。B. 外泌体样品粒径分布情况。C. 加入 Triton X-100 后粒径分布情况。D. PE-CD81或APC-CD63标记外泌体的表征率分析。
三、流式细胞术检测外泌体实验注意事项
1. 充分清除杂质:在上机前,先通过低速离心或过滤去除细胞碎片和大颗粒,减少背景信号。
2. 选择更亮的荧光标记:选择PE、APC等高亮染料标记的抗体和高亮的膜亲和荧光染料(如PKH、DiI),将外泌体“染亮”。注意去除多余染料,避免假信号。
3. 稀释样品:外泌体容易出现“swarm效应”,即多个小颗粒被当成一个事件。通过适当稀释样品并检查信号线性,可以避免这个问题。
4. 合理的对照设置:流式细胞术检测外泌体需要设置以下几种对照:
① 未染色对照: 用于调节电压和设定阴性群边界。
② 同型对照: 区分特异性与非特异性抗体结合。
③ 荧光扣除对照(FMO): 多色实验时尤为重要。
④ Triton X-100破膜对照: 用去垢剂破坏外泌体膜结构后,真正的阳性信号应显著减弱或消失,此对照是验证信号特异性的关键
5. 仪器校准与标准化:用已知大小和浓度的荧光微球校准仪器,可估算外泌体大小与浓度,提高可比性。
四、其他外泌体检测方式
除了流式细胞术,外泌体的检测与表征还可通过以下常用方法进行:
荧光染料标记示踪法:利用亲脂性荧光染料(如PKH67、PKH26、DiI、DiD、DiO等)与外泌体的脂质膜稳定结合,从而对其进行了荧光标记。标记后的外泌体可用于体外或体内研究,通过共聚焦显微镜、高内涵成像系统或活体成像系统追踪其被受体细胞的摄取情况、在生物体内的分布与归巢,是研究外泌体功能的重要工具。
电镜观察:通过电镜(透射电子显微镜TEM/扫描电子显微镜SEM等)观察样品中的颗粒形态、大小、结构等来鉴定外泌体。
Western Blot:通过检测外泌体标志蛋白(如CD9、CD63、CD81、TSG101、Alix等)来对分离的外泌体群体进行蛋白质水平的鉴定。
酶联免疫吸附测定(ELISA):利用外泌体表面特异性抗体进行捕获和检测,适用于外泌体的特异性定量分析。
五、abinScience外泌体相关流式抗体推荐
|
Target |
Clone |
CAT. |
Species |
Application |
|
CD9 |
SAA0003 |
HB984127 |
Human |
FCM, ELISA, WB |
|
CD63 |
MOF11 |
HY592127 |
Human |
FCM, ELISA, WB |
|
CD63 |
SAA1394 |
HY592227 |
Human |
FCM |
|
CD81 |
5A6 |
HX855127 |
Human |
FCM, WB |
abinScience流式抗体覆盖常用检测指标,品类丰富,可满足多物种科研实验需求,为您提供稳定可靠的支持,更多流式抗体列表详情,请访问abinScience官方网站。
参考文献
[1] Kim, G., Shon, O. J., Seo, M. S., Choi, Y., Park, W., & Lee, G. W. (2021). Mesenchymal Stem Cell-Derived Exosomes and Their Therapeutic Potential for Osteoarthritis. Biology, 10(4), 285.
[2] Théry, C., Witwer, K. W., Aikawa, E., Alcaraz, M. J., Anderson, J. D., Andriantsitohaina, R., … Zuba-Surma, E. K. (2018). Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles, 7(1), 1535750.
[3] Kowal, J., Arras, G., Colombo, M., Jouve, M., Morath, J. P., Primdal-Bengtson, B., … Théry, C. (2016). Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences, 113(8), E968–E977.
[4] van der Pol, E., B?ing, A. N., Harrison, P., Sturk, A., & Nieuwland, R. (2012). Classification, functions, and clinical relevance of extracellular vesicles. Pharmacological Reviews, 64(3), 676–705.
[5] Raposo, G., & Stoorvogel, W. (2013). Extracellular vesicles: exosomes, microvesicles, and friends. Journal of Cell Biology, 200(4), 373–383.
[6] Yá?ez-Mó, M., Siljander, P. R. M., Andreu, Z., Zavec, A. B., Borràs, F. E., Buzas, E. I., … De Wever, O. (2015). Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles, 4(1), 27066.
返回顶部