
在免疫学研究中,抗原特异性T细胞是理解抗病毒应答与疫苗效果的关键。然而,这些细胞往往频率极低,且在不同病原体驱动下呈现截然不同的分化特征。OMIP-002将pMHC-I multimer技术与多色流式表型分析相结合,不仅能在一次实验中同时捕捉多种抗原特异性CD8+T细胞,还能将这些稀有群体映射到分化轨迹之中,从而揭示不同病毒特异性免疫应答的独特模式。
一、方案指标
|
靶标 |
荧光素 |
作用 |
|
CD3 |
APC-Cy7 |
T细胞谱系标记 |
|
CD4 |
QD705 |
|
|
CD8 |
PE- Ax594 |
|
|
CD14 |
Pacific blue |
排除死细胞、B细胞、单核细胞、巨噬细胞 |
|
CD19 |
Pacific blue |
|
|
Dead cells |
VIVID |
|
|
CD27 |
PE-Cy5 |
记忆细胞、分化标志物 |
|
CD127 |
PE-Alexa700 |
|
|
CCR7 |
PE-Alexa750 |
|
|
CD45RO |
APC-Alexa700 |
|
|
CD57 |
FITC |
|
|
PD-1 |
Biotin-APC |
|
|
Multimer 1 |
PE |
不同pMHC-1多肽聚合体 |
|
Multimer 2 |
QD565 |
|
|
Multimer 3 |
QD605 |
|
|
Multimer 4 |
QD800 |
二、圈门逻辑

三、实验结果展示
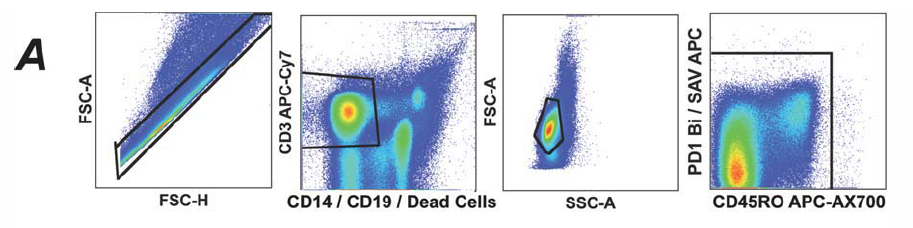
1. 去黏连(FSC-H/A),排除死细胞、B细胞、单核细胞(CD3+CD14-CD19-VIVID-),去除染料的黏连(CD45RO/PD-1)。
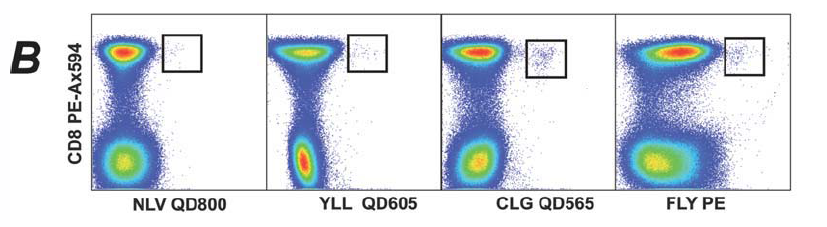
2. 在CD3+细胞中通过CD8与Multimer确定哪些细胞识别pMHC-1多肽聚合体。
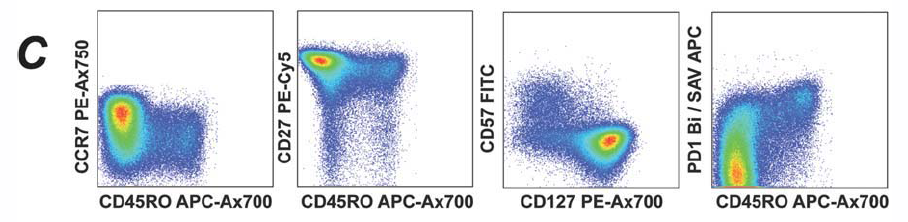
3. 在CD8+中确定不同细胞表型。
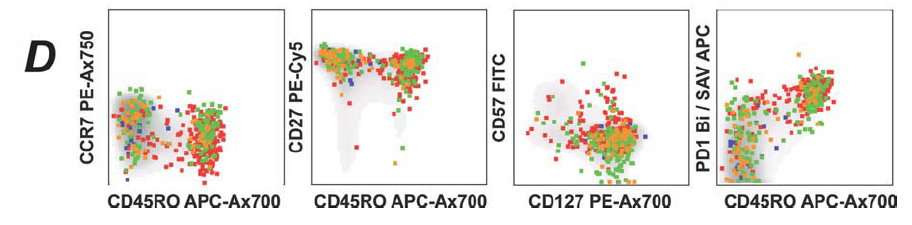
4. 把B图中的multimer+事件投影到C图中,展示不同pMHC-1多肽聚合体在不同表型细胞中的表达情况。
四、方案解读
1. 多抗原特异性细胞并行检测
一次实验用4个pMHC-I multimer同时捕捉CMV和EBV的不同表位特异性CD8+T细胞。解决了低频群体检测的低通量问题,大幅提高实验效率。
2. 抗原特异性群体的表型直接映射
将multimer+胞投射到CCR7/CD45RO/CD27等分化坐标上,直观显示不同病毒特异性群体的分化偏好。第一次把低频特异性T细胞的识别和分化表型解读完整整合到一个panel里。
3. 标准化、可复现的面板设计
panel中的marker排布与荧光选择经过优化,使低频multimer信号和分化表型都能被清晰分辨。为当时的多色流式提供了可直接复现的实验模板。
五、小结
OMIP-002展示了一种精准捕捉稀有抗原特异性T细胞,并直接解析其分化状态的流式策略。它不仅回答“有多少”,还能揭示“是什么状态”,成为研究病毒应答、疫苗免疫和免疫衰老的经典方案。
参考文献
[1] Chattopadhyay, P.K., Roederer, M. and Price, D.A. (2010), OMIP-002: Phenotypic analysis of specific human CD8+ T-cells using peptide-MHC class I multimers for any of four epitopes?. Cytometry, 77A: 821-822.

abinScience创立于法国,专注于高质量生命科学试剂的开发与生产,立足法国斯特拉斯堡创新科技中心,以“Empowering Bioscience Discovery”为愿景,为全球科研人员提供创新型解决方案。
返回顶部