
2025年10月6日,诺贝尔生理学或医学奖授予三位科学家:玛丽·布伦科(Mary E. Brunkow,美国)、弗雷德·拉姆斯德尔(Fred Ramsdell,美国)和志本坂口(Shimon Sakaguchi,日本)。他们破解了一个关键问题:免疫系统如何避免“误伤”自身组织,防止像系统性红斑狼疮(SLE)或1型糖尿病这样的自身免疫疾病。答案是调节性T细胞(Tregs)和FOXP3基因——Tregs像免疫系统的“交通警察”,指挥免疫反应不过度;FOXP3是“总开关”,决定Tregs是否正常工作。故事始于1995年,坂口发现一种特殊T细胞(标记为CD4+ CD25high),能抑制其他免疫细胞的过度活跃,维持身体的免疫平衡。2001年,布伦科和拉姆斯德尔研究了scurfy小鼠,这种小鼠因免疫失控导致皮肤粗糙、早夭。他们发现,FOXP3基因突变让Tregs无法工作。在人类中,FOXP3突变引发IPEX综合征,患者常因免疫攻击导致糖尿病、肠炎等。这项发现将Tregs从模糊概念变成了有明确分子基础的科学事实。
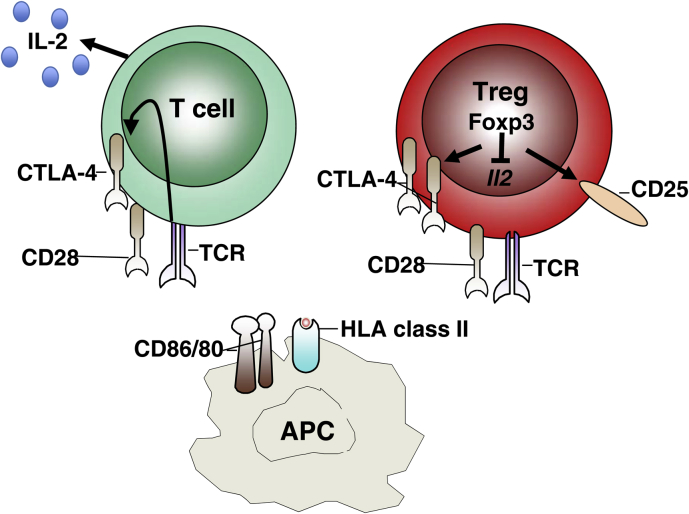
Fig 1. CTLA-4 / CD28 / FOXP3 关系总览(Walker, 2013)
Tregs和FOXP3的研究是一段30年的科学旅程。1995年,坂口率先提出Tregs的概念,证明这些细胞能抑制免疫反应,维持身体平衡。2001年,布伦科和拉姆斯德尔通过scurfy小鼠锁定FOXP3基因,揭示其对Tregs的核心作用。2003年,科学家确认FOXP3突变与人类IPEX综合征相关,连接了动物模型与临床。2010年,Tregs进入临床试验,用于治疗自身免疫病和移植排斥。2020年,单细胞RNA测序技术揭示Tregs的多样性,如在肿瘤和感染中的不同行为。2025年,这一系列突破因其深远影响获诺贝尔奖肯定。
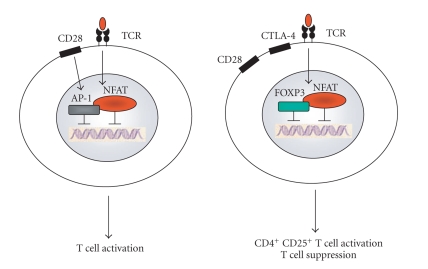
Fig 2. NFAT × FOXP3 转录调控比较(van der Vliet & Nieuwenhuis, 2007)
想象免疫系统是一辆跑车,跑得太快可能撞毁自己的“房子”(身体组织)。调节性T细胞(Tregs)就像刹车,防止失控;FOXP3基因是刹车踏板的控制芯片,决定刹车灵不灵。免疫系统在胸腺(像“驾校”)已学会避开大部分自抗原,但总有些漏网的麻烦分子。Tregs在血液和组织中接手,维持和平。Tregs有几种“刹车”方式:一是“抢”走IL-2(白细胞介素-2),一种让免疫细胞兴奋的信号分子,让其他T细胞“饿”着没力气闹事;二是分泌IL-10或TGF-β,像安抚剂一样平息炎症;三是通过CTLA-4切断其他T细胞的“电源”,阻止它们激活。如果FOXP3坏了(像scurfy小鼠或IPEX患者),Tregs就失灵,免疫系统会攻击身体,导致严重疾病。最近,单细胞RNA测序发现,Tregs并非一模一样:在肿瘤里,它们可能“刹车过度”,压制抗癌免疫;在COVID-19感染后,它们会增加IL-10,帮助平息过度炎症。这种多样性让Tregs调控更精准。
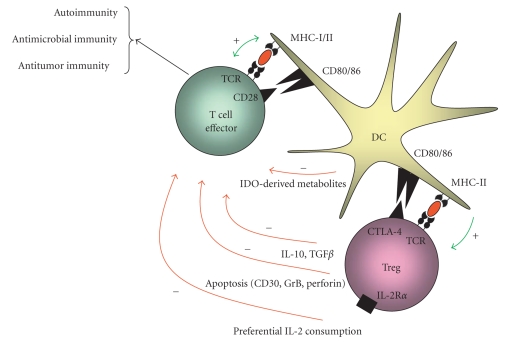
Fig 3. Treg 抑制机制(IL-2 竞争、CTLA-4等)(van der Vliet & Nieuwenhuis, 2007)
这个发现不只是学术突破,它为多种疾病治疗带来了希望。在自身免疫病,如系统性红斑狼疮(SLE)或1型糖尿病,增强Tregs功能可以“踩下刹车”,阻止免疫攻击;在器官移植中,Tregs能减少排斥反应,让移植器官存活更久。在癌症中,Tregs可能“刹车过度”,压制抗肿瘤免疫,因此科学家开发了抗CTLA-4抗体如伊匹单抗,部分解除Tregs抑制,帮助免疫系统攻击癌细胞。产业也在行动:低剂量IL-2变体和Treg细胞疗法正进入临床试验,治疗移植物抗宿主病(GVHD)等。研究还推动实验标准提升:科学家更注重批间一致性和数据透明,确保结果可信、可重复。这加速了从实验室到临床的转化。
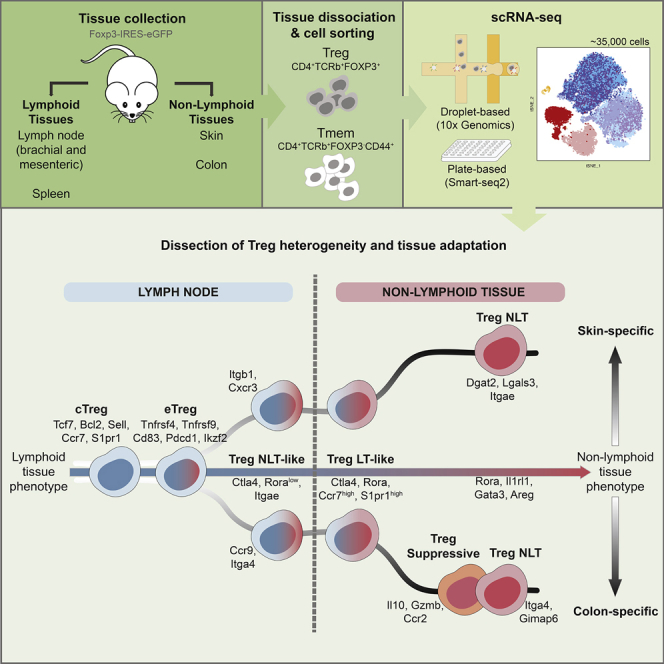
Fig 4. Graphical Abstract. Treg 单细胞组织适应与异质性(Miragaia et al., Immunity 2019)
诺奖机制直接指导实验室工作。以下是Tregs/FOXP3研究的关键指标,覆盖主要领域,帮你设计可靠实验。
*核心指标以★★★★★表示,扩展指标以★★★表示,反映其在研究中的重要性。
| 研究领域 | 指标 | 功能 | 核心评分 |
|---|---|---|---|
| Treg诱导 | IL-2 | 诱导iTregs,调控T细胞活性,促进STAT5磷酸化 | ★★★★★ |
| 自免、肿瘤、移植 | FOXP3 | 核染色,评估Treg功能和身份 | ★★★★★ |
| 通路研究 | CTLA-4 | 阻断T细胞激活,验证免疫抑制作用 | ★★★★★ |
| 炎症调控 | IL-10 | 平息炎症,评估Treg分泌功能 | ★★★★★ |
| Treg诱导 | TGFB1 | 诱导Tregs,抑制免疫反应 | ★★★★★ |
| 自免、肿瘤、移植 | IL2RA(CD25) | 标记Tregs,检测高表达水平 | ★★★★★ |
| Treg分选 | IL7R(CD127) | 反向门控,低表达用于Treg分选 | ★★★★★ |
| 通路研究 | STAT5(pSTAT5 Y694) | 评估IL-2信号通路,检测磷酸化状态 | ★★★★★ |
| 通路研究 | CD28 | 提供共刺激信号,增强T细胞激活 | ★★★★★ |
| 通路研究 | CD80 | 与CD28/CTLA-4结合,调控T细胞活性 | ★★★★★ |
| 通路研究 | CD86 | 与CD28/CTLA-4结合,调控T细胞活性 | ★★★★★ |
| 肿瘤免疫 | PDCD1(PD-1) | 抑制T细胞活性,评估免疫检查点 | ★★★★★ |
| 肿瘤免疫 | TIGIT | 抑制T细胞活性,评估免疫检查点 | ★★★★★ |
| 通路研究 | ICOS | 增强Treg功能,评估激活状态 | ★★★★★ |
| 肿瘤免疫 | TNFRSF4(OX40) | 调控Treg与效应T细胞平衡 | ★★★★★ |
| 自免、肿瘤 | TNFRSF18(GITR) | 调控Treg功能,增强免疫反应 | ★★★ |
| Treg迁移 | CCR4 | 指导Tregs向炎症部位迁移 | ★★★ |
| Treg迁移 | CCR7 | 指导Tregs向淋巴结迁移 | ★★★ |
| Treg迁移 | CCR8 | 肿瘤微环境中Treg定位 | ★★★ |
| Treg稳定性 |
IKZF2(Helios) |
标记稳定Tregs,核染色 | ★★★ |
| Treg稳定性 | IKZF4(Eos) | 调控Treg基因表达,核染色 | ★★★ |
| Treg稳定性 | BACH2 | 维持Treg稳定性,抑制分化 | ★★★ |
| Treg功能 | PRDM1(BLIMP-1) | 调控Treg抑制功能 | ★★★ |
| 通路研究 | IL2RB(CD122) | 支持IL-2信号传导 | ★★★ |
|
通路研究 |
IL2RG(CD132) | 支持IL-2信号传导 | ★★★ |
诺奖机制启发了一系列实验工具,助力Tregs/FOXP3研究。以下产品涵盖关键指标的抗体和重组蛋白,支持流式细胞术、功能验证和信号通路研究。
| 靶点 | 货号 | 产品名称 |
|---|---|---|
| FOXP3 | HV388215 | Anti-Human FOXP3 Monoclonal Antibody (1A208), APC |
| HV388012 | Recombinant Human FOXP3 Protein, N-His | |
| IL2RA (CD25) | HF996137 | Anti-Human CD25/IL2RA Antibody (1H4), APC |
| HF996011 | Recombinant Human CD25/IL2RA Protein, C-His | |
| IL7R | HB016337 | Anti-Human CD127/IL7R Antibody (4A10), APC |
| HB016011 | Recombinant Human CD127/IL7R Protein, C-His | |
| CTLA4 | HB651237 | Anti-Human CD152/CTLA4 Antibody (11.2.1), APC |
| HB651011 | Recombinant Human CD152/CTLA4 Protein, C-His | |
| IL10 | HB997137 | Anti-Human IL10 Antibody (SAA0378), APC |
| HB997012 | Recombinant Human IL10 Protein, C-His | |
| TGFB1 | HF977137 | Anti-Human TGFB1/TGF-beta-1 Antibody (SAA0180), APC |
| HF977011 | Recombinant Human TGFB1/TGF-beta-1 Protein, C-His | |
| STAT5 (pSTAT5 Y694) | HW724014 | Anti-STAT5A Polyclonal Antibody |
| HW724012 | Recombinant Human STAT5A Protein, N-His | |
| CD28 | HY422237 | Anti-Human CD28 Antibody (15E8#), APC |
| HY422021 | Recombinant Human CD28 Protein, C-His | |
| CD80 | HW630137 | Anti-Human CD80/B7-1 Antibody (IDEC-114), APC |
| HW630011 | Recombinant Human CD80/B7-1 Protein, C-His | |
| CD86 | HW776337 | Anti-Human CD86/B7-2 Antibody (2331/FUN-1), APC |
| HW776011 | Recombinant Human CD86/B7-2 Protein, C-His | |
| PDCD1 (PD-1) | MC096023 | Anti-Mouse CTLA4 & PD1 Bispecific Antibody (SAA2362) |
| TIGIT | HS739137 | Anti-Human TIGIT Antibody (SAA0153), APC |
| HS739011 | Recombinant Human TIGIT Protein, C-His | |
| ICOS | HV702137 | Anti-Human CD278/ICOS Antibody (SAA0091), APC |
| HV702012 | Recombinant Human CD278/ICOS Protein, N-His | |
| TNFRSF4 (OX40) | HW342337 | Anti-Human CD134/TNFRSF4/OX40 Antibody (3C8), APC |
| HW342011 | Recombinant Human CD134/TNFRSF4/OX40 Protein, C-His |
注:所有经过严格质控,纯度超过95%。
近期进展显示,Tregs 在肿瘤微环境中呈现 情境依赖的双重作用:既可抑制抗肿瘤免疫,也可能在特定微环境中维持免疫稳态。 围绕 OX40 等共刺激受体的调节策略(含激动剂)正逐步被提出,但其 剂量窗、给药时机以及与放/化疗或免疫检查点抑制剂的联用仍需在前瞻性研究中精细化验证。
在感染与组织修复场景——包括 COVID-19 的研究中——越来越多证据显示 Tregs 通过 IL-10 等途径有助于抑制过度炎症并支持组织修复。不过,“修复”与“抗病毒清除”之间的权衡,以及干预的时序与人群差异,仍需在前瞻性研究与临床试验中进一步界定。
同时,AI 驱动的免疫建模(如多组学特征选择、细胞状态迁移轨迹推断、数字孪生/体外数据增强) 正被用于刻画更精细的 Treg 调控参数空间,帮助在“抑制 vs. 促进”之间找到可重复、可量化的优化点。
从产业侧看,多方预测认为 Treg 相关治疗在本十年仍将保持增长,规模或在 2030 年左右达到 数十亿美元量级,相应地也将 提升对高质量检测与功能验证工具 的需求。
在具体研究执行上,建议优先聚焦三类问题:
结合“先分型、再看通路、最后落到功能”的常见流程,abinScience 提供的 FOXP3、IL-2/IL-2RA、CTLA-4、OX40、IL-10、TGF-β、pSTAT5(Y694)、PD-1、ICOS、TIGIT 等试剂,可顺畅支撑 表型识别、信号检查 与 功能评估 三个环节的衔接。
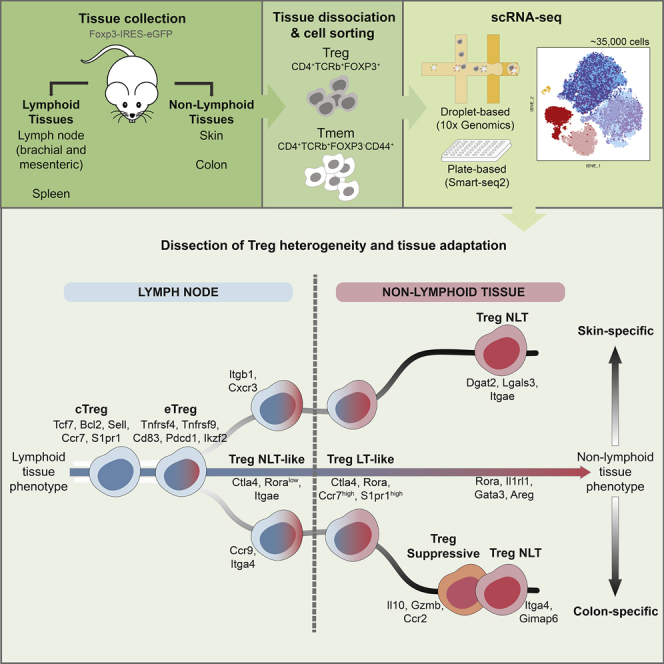
Fig 5. Graphical Abstract. Treg 单细胞组织适应与异质性(Miragaia et al., Immunity 2019)
abinScience 品牌创立于法国斯特拉斯堡,依托14年的蛋白抗体开发经验,专注于高质量生命科学试剂的研发与生产。自2023年成立以来,abinScience始终秉持“Empowering Bioscience Discovery”的愿景,致力于为全球科研人员提供高效、可靠的实验解决方案,赋能前沿生命科学研究。
返回顶部