
OMIP是ISAC(国际流式学会,1976年成立)旗下Cytometry PART A杂志中的专栏,全称为Optimized Multicolor Immunofluorescence Panels。其文章分线上(补充材料文档含多种技术细节)和线下(两页电子PDF文档含实验相关内容)两部分,自2010年第一篇发表至今已有108篇,旨在为研究人员提供可直接应用的标准化流式检测方案。
作为系列首篇,OMIP-001聚焦于人外周血T细胞的分化与功能状态,通过精心设计的抗体组合,在有限通道内获取尽可能全面的信息。
一、方案指标
|
靶标 |
荧光素 |
作用 |
|
CD3 |
APC-Cy7 |
T细胞谱系标记 |
|
CD4 |
QD605 |
|
|
CD8 |
QD585 |
|
|
CD14 |
Pacific blue |
排除死细胞、B细胞、单核细胞、巨噬细胞 |
|
CD19 |
Pacific blue |
|
|
Dead cells |
VIVID |
|
|
CD27 |
PE-Cy7 |
记忆细胞、分化标志物 |
|
CD28 |
PE-Cy5 |
|
|
CD45RO |
QD545 |
|
|
CD57 |
QD705 |
|
|
CD127 |
PE |
|
|
CCR7 |
Alexa680 |
|
|
PD-1 |
QD655 |
|
|
IFN-γ |
APC |
功能性标志物 |
|
IL-2 |
Alexa488 |
|
|
TNF-α |
Alexa594 |
二、圈门逻辑
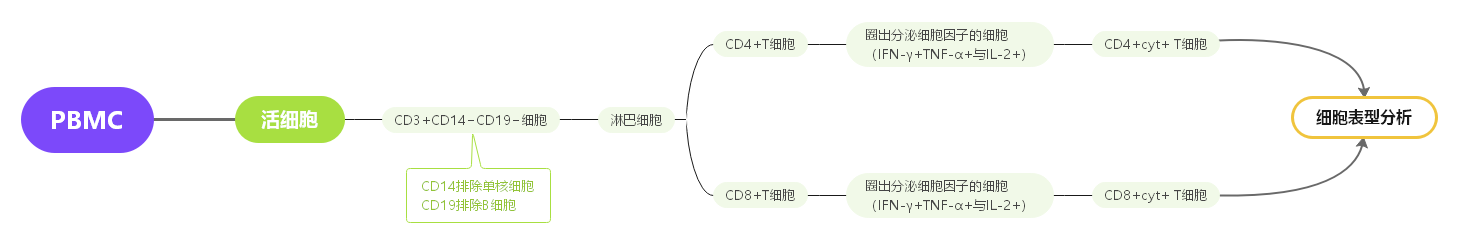
三、实验结果展示
1. FSC-A/H去黏连,然后通过CD3+CD14-CD19-VIVID-圈出活的CD3+细胞,进一步通过指标的两两组合去除染料粘连造成的各通道非特异性信号,FCS-A/SSC-A圈出淋巴细胞,最后分别圈出CD4+T细胞和CD8+T细胞。
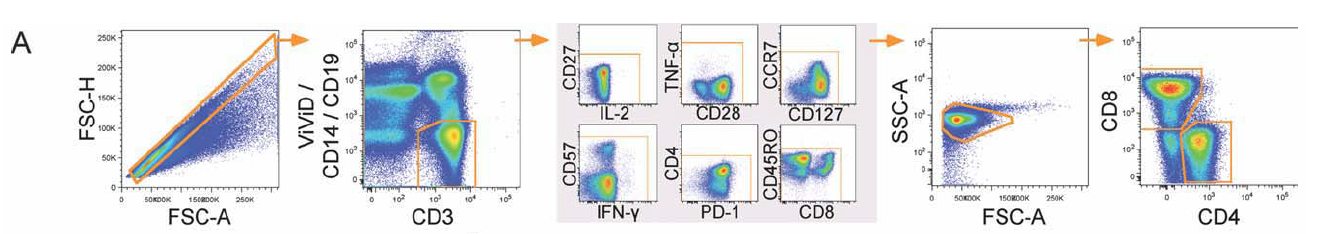
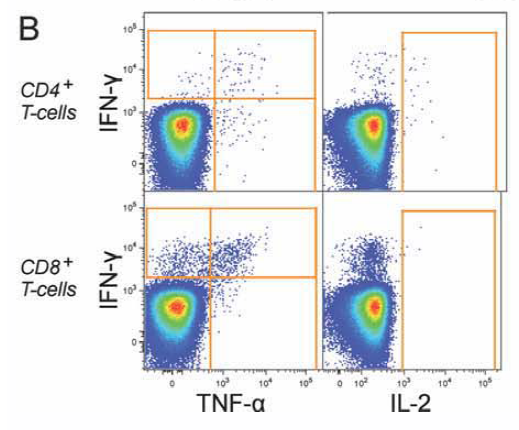
2. 分别在CD4+T细胞和CD8+T细胞中确定能分泌细胞因子IFN-γ、TNF-α及IL-2的细胞。
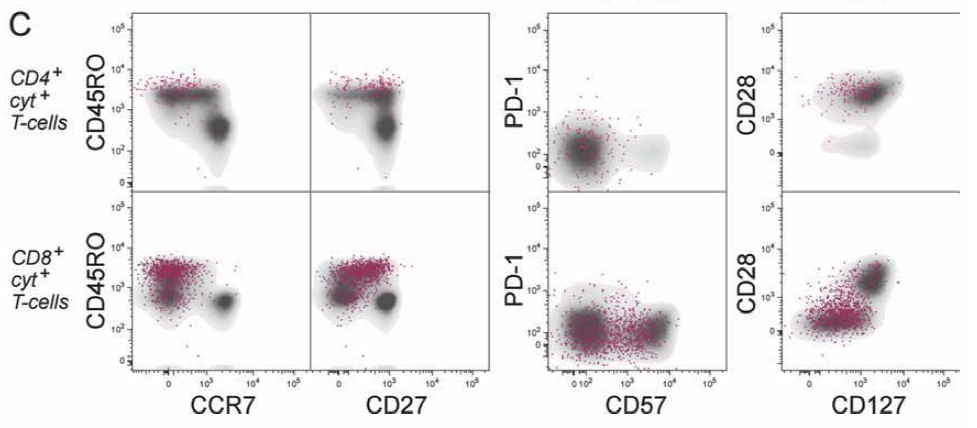
3. 使用FlowJo的Boolean gate功能圈包含所有细胞因子阳性细胞(cyt+)的布尔门,之后再使用不同抗体组合来评估HIV-1抗原特异性反应T细胞的表型。(灰色:总CD4+或CD8+T细胞,红色:分泌细胞因子的细胞)
四、方案解读
功能评估(整体水平)
首先在总CD4+ T细胞和总CD8+ T细胞中,检测IFN-γ、TNF-α、IL-2的分泌情况。这些细胞因子分别代表杀伤能力(IFN-γ)、炎症效应(TNF-α)和长期存活潜能(IL-2)。使用FlowJo的Boolean gate功能,将所有分泌任意一种因子的T细胞定义为cytokine-positive(cyt+)群体。这样获得了一个功能性T细胞的总体图景。
表型关联(群体细化)
接着,将cyt+细胞再映射回不同的表面标志物组合:
CD45RO/CCR7→划分Na?ve/TCM/TEM/TEMRA(判断长期记忆vs短期效应);
CD45RO/CD27→判断记忆是否保留共刺激/增殖潜力(CD27+=潜力高);
CD57/PD-1→区分终末效应(CD57+PD-1^low)与耗竭/受抑(PD-1^high);
CD127/CD28→评估细胞是否仍保有长期存活与再激活潜能,或已走向功能受限。
通过这一策略,OMIP-001不只是告诉我们“T细胞分化到哪一步”,还进一步揭示:
哪些记忆亚群保留了高功能潜力?
哪些衰老或耗竭群体仍能分泌因子?
哪些群体在增殖和再生方面更具优势?
五、小结
OMIP-001的独特之处在于“表型+功能”的双层逻辑:
1. 先整体评估CD4+和CD8+ T细胞的因子分泌能力;
2. 再利用Boolean gate定义功能性群体;
3. 最终映射到表型分群,解读不同亚群的功能状态。
这种层层递进的分析方式,让研究者不仅能勾勒出T细胞的分化轨迹,还能直观了解 不同阶段T细胞的真实功能潜力。因此,它不仅适用于基础免疫学研究,还在疫苗评估、慢性感染监测和肿瘤免疫分析中展现出广阔的应用前景。
参考文献:
[1] Mahnke YD, Roederer M. OMIP-001: Quality and phenotype of Ag-responsive human T-cells. Cytometry A. 2010 Sep;77(9):819-20.

abinScience创立于法国,专注于高质量生命科学试剂的开发与生产,立足法国斯特拉斯堡创新科技中心,以“Empowering Bioscience Discovery”为愿景,为全球科研人员提供创新型解决方案。
返回顶部