
在流式细胞术中,单阳对照(Single-Stained Control)是指为每种荧光染料单独设置的样本,只包含一种荧光标记的阳性信号(通常为标记抗体的细胞或补偿磁珠),用于校正多色流式实验中的光谱溢出(spillover)。单阳对照通过提供纯净的荧光信号,帮助生成准确的补偿矩阵,是确保数据可信度的基础。需要注意的是,单阳对照与FMO(Fluorescence Minus One,荧光减一对照)作用不同,FMO用于确定门限或阈值,不可替代单阳对照的补偿功能。
在多色流式实验中,“补偿”常被视作软件自动计算的结果,只要算法正确、通道设置合理,数据似乎就不会出错。然而,真正决定补偿矩阵精度的因素,其实隐藏在更早的步骤——单阳对照的信号质量。一个干净、亮度合适、分群清晰的单阳对照,不仅是算法计算的基础,更是实验数据可信度的起点。
多色流式实验中,不同荧光素之间的光谱溢出不可避免(图1)。补偿算法能够校正这种溢出,但其准确性却完全依赖于单阳对照信号的质量。
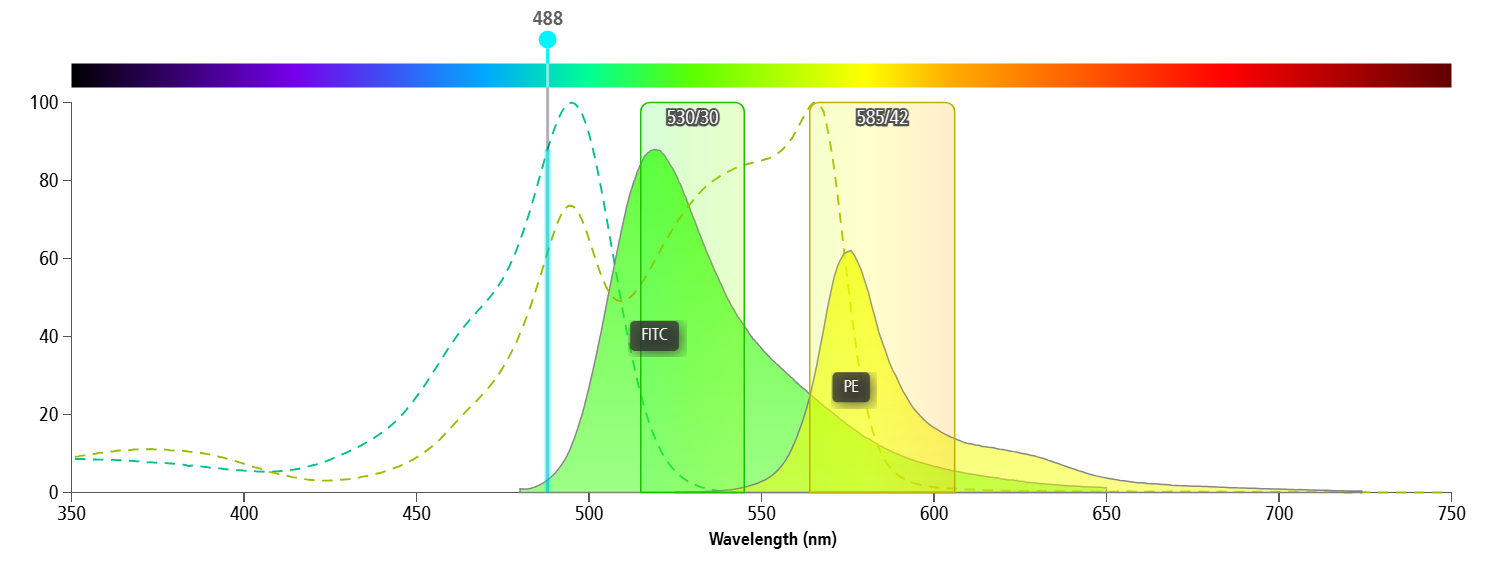
图1. 光谱溢出
在很多补偿偏移或数据重叠的案例中,问题往往并不出在软件,而是出在“单阳信号不合格”——亮度不够、群体模糊、或者样本与panel不匹配。
单阳对照定义了每个通道的纯荧光信号,是补偿矩阵计算的依据。因此,它不只是“有就行”,而是必须满足以下条件:
1. 信号亮度合适:阳性群信号应充分高于背景,但不能溢出检测范围。
2. 阴阳区分清晰:可通过Staining Index(SI)或信噪比进行评估。
3. 样本匹配:单阳管与全染管在细胞类型、固定/破膜条件、电压设定上保持完全一致。
4. 阳性群比例充足:确保软件能识别阳性事件,用于矩阵计算。
这些参数共同决定了补偿矩阵的“稳定性与可复现性”,而非单纯的“通道校正”。
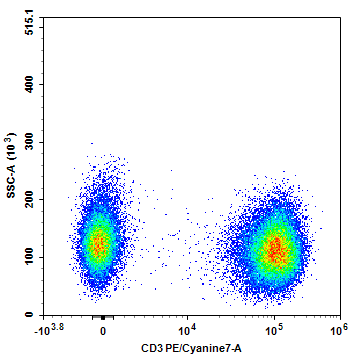
图2. CD3单阳对照信号
单阳信号的质量可通过以下特征进行判断(注:Staining Index公式为 SI = (MFI_pos ? MFI_neg) / (2 × SD_neg),可用robust SD提高稳健性):
|
检测点 |
理想状态 |
常见问题 |
可能后果 |
|
阳性信号强度 |
明显高于阴性群 |
信号过弱或过亮 |
补偿偏移或矩阵失真 |
|
分群界限 |
阴阳群分界清晰 |
阴阳混合、不分明 |
软件识别失败 |
|
阴性群位置 |
分布稳定 |
阴性群漂移 |
可能出现补偿后负值 |
|
细胞状态 |
FSC/SSC稳定 |
死细胞比例高 |
非特异信号干扰 |
实用技巧:
① 对低表达marker(如IL-17A、Foxp3等),可用同荧光标记的高表达marker(如CD3、CD4等)替代做单阳。
② 在荧光串联染料(PE-Cy7、APC-Cy7等)中,优先使用同批次/同品牌的串联染料以确保补偿稳定性,可使用补偿磁珠而非细胞,避免染料断裂带来的信号异常。固定/破膜会影响部分染料亮度,单阳与全染必须使用完全相同的处理流程。
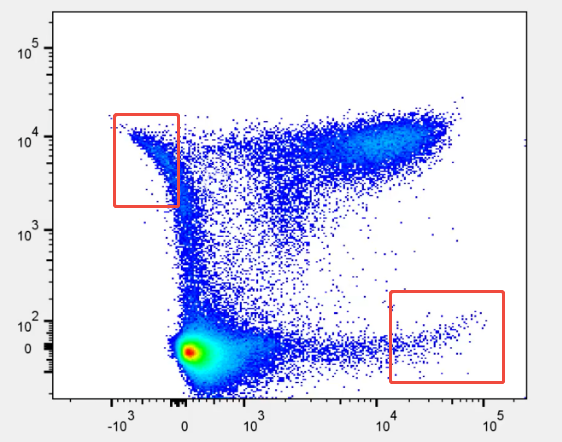
图3. 实验结果中出现补偿后象限偏移
当出现分群不直、数据漂移或补偿后象限偏移时,直接原因通常是补偿设置不合理,即补偿值过高或不足。但在进一步追溯时可以发现,这种补偿偏差往往源自单阳信号质量不佳或实验条件不一致——阳性群过弱、阴阳分界不清、样本处理方式不同等因素,都会使补偿矩阵计算的基础信号带有误差。
换句话说,看似补偿算法的问题,实质上是单阳信号不够“干净”导致补偿设定本身就不准确。
常见误区:
1. 把信号问题误当成补偿错误:看到数据偏移,就立即重算矩阵,却忽略了单阳信号本身是否干净。
2. 单阳信号过弱或过亮:阳性群过弱导致软件无法识别阴阳界限,过亮则使信号溢出检测范围,双双引起补偿比例偏差。
3. 单阳与全染条件不一致——样本类型、电压设定或固定/破膜方式不同,都会改变荧光强度,使补偿结果失真。
4. 异常高的补偿值未被正确解读:当补偿值较历史值显著偏大(如>100%),且伴随信号亮度或分群异常,需怀疑串联染料(如PE-Cy7、APC-Cy7)降解或制备问题,但高补偿值本身可能因滤片配置或光谱重叠正常。
5. 误判补偿后负值:补偿后出现负值可能因噪声建模或数据分布正常,需结合单阳群形、阴阳分离度和历史矩阵判断是否异常,而非直接视为错误。
因此,在排查补偿问题时,第一步应重新检查单阳信号,确保其干净可靠,结合历史数据和分群质量综合判断,而非直接重算矩阵。
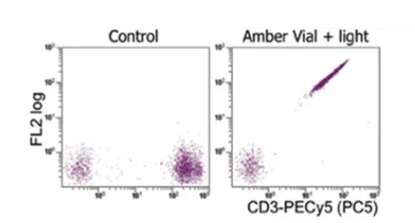
图4. 串联染料光谱溢出异常结果图(图片来源于网络)
Panel前规划:选择光谱重叠低的荧光素组合,减少补偿压力。
优先信号质量:单阳信号宁可略亮,也不要模糊。
确保一致性:单阳与全染管在样本类型、电压、固定/破膜等条件上完全同步,电压调整后需重新获取单阳。
合理使用磁珠:在串联染料、难获取阳性细胞或样本量不足时,可选择补偿磁珠以提高信号稳定性。
采集顺序:先完成每日CS&T/仪器质控,再采集单阳对照,最后上样全染样本,确保数据可复现。
定期质控:每次实验后检查补偿矩阵,若补偿值异常偏大或出现负值,结合单阳信号亮度、分群质量和历史矩阵回溯问题。
以下是一个四色流式实验的单阳对照设置,用于检测人类外周血单核细胞(PBMC)中的Treg细胞亚群,抗体包括CD3-PerCP、CD4-FITC、CD25-APC和Foxp3-PE,我们需要设置4管单阳对照(表1)。
表1. 单阳对照设置参考表
|
编号 |
加入抗体 |
样本处理 |
|
1 |
CD3-PerCP |
需要固定破膜 |
|
2 |
CD4-FITC |
需要固定破膜 |
|
3 |
CD25-APC |
需要固定破膜 |
|
4 |
Foxp3-PE |
需要固定破膜 |
备注:
①所有单阳对照与全染样本使用相同PBMC批次和仪器设置(如BD FACSCanto II),电压调整使阳性信号在104-105范围内,每管收集至少10,000个事件。
②CD25属于连续表达,Foxp3属于低表达,二者可以用相同荧光标记的高表达指标替代,如:用CD3-APC代替CD25-APC,用CD3-PE代替Foxp3-PE。替代的指标虽然属于胞外指标,或者使用补偿磁珠结合对应的抗体。
③Foxp3是核内转录因子,4管单阳对照不管是用高表达指标还是用补偿磁珠替代都要进行固定破膜。
这个例子展示了单阳对照的设置和验证流程,强调信号强度、分群清晰度和实验条件一致性的重要性,为可靠的补偿矩阵提供基础。
单阳对照是多色流式中最容易被忽视、却最具决定性的一环。一个干净、清晰、稳定的单阳信号,是构建可靠补偿矩阵的前提;而一个失真的补偿矩阵,则足以让整组数据失去解释价值。在日益复杂的多色panel设计与高通量分析中,回归信号质量、重视单阳对照,依然是保证实验稳定性和数据可信度的核心。让每一次补偿都“算得稳”,从关注单阳对照开始。
关于我们

abinScience创立于法国,专注于高质量生命科学试剂的开发与生产,立足法国斯特拉斯堡创新科技中心,以“Empowering Bioscience Discovery”为愿景。其流式抗体产品覆盖常用检测指标,品类丰富,可满足多物种科研实验需求,为科研提供稳定可靠的支持,更多流式抗体列表详情可访问abinScience官方网站获取更多产品信息。
返回顶部