
在多色流式实验数据分析中,我们习惯于讨论阳性信号的强弱,却往往忽视了“阴性”的背景基线。同型对照(Isotype Control)提供抗体-样本体系的背景基线,用于评估非特异性结合与噪声;阈值/门限判定建议以 FMO 对照为准;补偿计算必须使用单染(Single-Stained)对照。合理的同型对照设置能揭示信号背后的噪声结构,从而判断真正的表达是否成立。
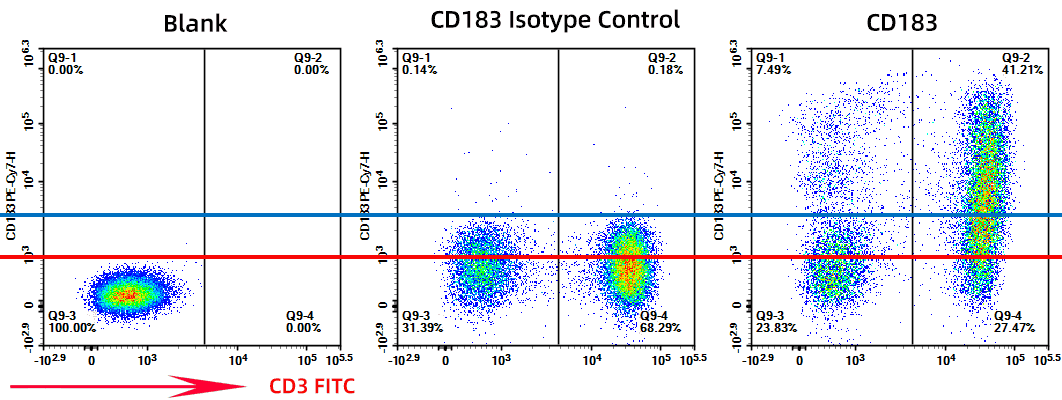
图1. 使用空白设门(红线)与用同型对照设门(蓝线)对比
同型抗体与目标抗体在宿主来源、Ig 亚型及荧光素标记上保持一致,但缺乏对目标抗原的特异性结合能力。它提供一个抗体-样本体系的背景基准,用于评估非特异性结合和体系噪声。同型对照用于评估抗体-样本体系的背景与非特异性结合;阈值/门限判定建议以 FMO 对照为准;补偿计算必须使用单染(Single-Stained)对照。
当样本存在较强Fc受体、非特异性结合或自发荧光时,同型对照能揭示系统噪声水平,使“阳性”判断基于实验体系的稳定性,而非主观划线。更重要的是,同型信号能作为体系问题的“放大镜”:
评估Fc受体结合残留:若单核细胞或B细胞中信号升高,提示Fc阻断不足。
识别荧光染料的聚集或泄漏:部分高亮染料(如PE、PerCP-Cy5.5)背景水平差异较大。
验证胞内染色的完整性:固定/破膜后若背景显著增加,同型对照能揭示这一变化。
对照角色速查表
|
对照类型 |
主要用途 |
不能替代 |
|
未染(Unstained) |
看自发荧光、设电压参考 |
FMO、同型、单阳 |
|
同型(Isotype) |
评估非特异性结合/体系背景 |
FMO(设门)、单阳(补偿) |
|
FMO |
设门/阈值的金标准 |
同型、单阳 |
|
单阳(Single-Stained) |
补偿矩阵与溢出/展宽评估 |
FMO、同型 |

图2. CD45不同处理下染色结果(未阻断染同型对照,背景升高,提示FcR阻断不足;FcR阻断后背景下降)
理论上,只要同型抗体与目标抗体在物种、亚型、荧光素比例及浓度上完全一致,就能准确反映背景水平。但这在实践中几乎不可能完全满足。不同批次间的荧光素与蛋白的比例、抗体纯度等微小差异,都可能导致信号漂移。因此,同型对照虽有参考意义,却不应被绝对化使用。
在完成 FMO 设门、死细胞排除、充分 Fc 阻断与抗体滴定且目标抗原强表达/双峰明显时,可考虑不配同型对照。以下为决策参考:
何时考虑加入同型对照?
? 低/中低表达、连续分布的抗原(阈值难判)
? FcR 高表达细胞(单核细胞、巨噬细胞、B细胞、粒系)
? 胞内染色/固定破膜(背景常上升)
? 样本经刺激/培养/冻融(体系噪声提升)
? 新面板验证/新批次抗体上线(做法定基线)
何时可以不配?(满足全部或大部分)
? 阈值以 FMO 明确设定且阴阳分离度大
? 目标抗原强阳/双峰明显
? 已完成死细胞排除、Fc 阻断充分、抗体滴定达最佳
? 有历史基线与质控记录可依
即便保留同型对照,实验设计仍需兼顾体系背景的控制,以下为优化建议:
进行抗体验证与滴定:抗体量过多会导致阴性峰偏移、基底增宽,干扰阈值判断。滴定至最佳浓度,确保信号清晰。
关注非特异性结合来源:若同型信号偏高,优先使用与细胞种属匹配的Fc阻断剂(如人样本用人类IgG或专用Fc block),先阻断再加抗体。可使用含免疫球蛋白/血清的封闭液进一步降低背景。
配合活性染料排除死细胞:死细胞的非特异性染色极强,往往造成背景“假阳性”。使用胺反应性活性染料(如Zombie dyes),在表面染色前或上样前完成死细胞标记。
谨慎设定门限:同型对照仅反映抗体的非特异性结合,不能单独作为阳/阴性划分依据。光谱展宽(Spillover Spreading)需通过SSM/CSI指标结合单阳和FMO评估。
处理高自发荧光样本:组织、老年样本或髓系细胞需保留未染对照并尝试自发荧光校正通道/模型,同型对照仅覆盖抗体相关背景,无法替代自发荧光校正。
严格匹配:宿主种属、Ig 亚类(如mouse IgG1 κ)、荧光素、偶联工艺/批次、缓冲体系尽量一致。
同量或同效量:与目标抗体同最终浓度/同质量,或滴定至目标抗体等效背景位移;避免“同型过量”导致假高背景。
条件一致:与全染同一固定/破膜流程、温度/时间、洗涤、阻断、电压/增益。
判读原则:同型MFI ≈ 未染MFI为理想;若同型显著高于未染,优先排查Fc阻断不足、抗体过量、死细胞残留。
以下是一个单色流式实验中选择和应用同型对照的实例,用于检测人类外周血单核细胞(PBMC)中的IL-17A-PE-Cy7(胞内染色)表达。
1. 实验背景:IL-17A为低表达抗原,PBMC含FcR高表达细胞(单核细胞、B细胞),且涉及固定/破膜,需同型对照评估非特异性结合。仪器为BD FACSCanto II。
2. 同型对照选择:为IL-17A-PE-Cy7(mouse IgG1 κ,PE-Cy7标记,浓度1 μg/mL)选择同型抗体mouse IgG1 κ-PE-Cy7,来自同一供应商、批次,荧光素/抗体比例匹配,浓度调整至1 μg/mL(滴定确认等效背景位移)。
3. 实验流程:取约1×10^6个PBMC,先用Zombie Aqua(胺反应性染料)标记死细胞(4°C,15分钟),洗涤后用人类IgG(10 μg/mL)进行Fc阻断(4°C,10分钟)。随后加入mouse IgG1 κ-PE-Cy7同型抗体,4°C孵育30分钟,洗涤后按全染样本相同的固定/破膜试剂盒(eBioscience)处理。所有样本使用相同缓冲液、离心条件和PMT电压(预先通过CS&T质控校准),收集至少10,000个事件。
4. 结果与判读:同型对照在PE-Cy7通道的MFI约为200,与未染样本MFI(150)接近,表明背景低、Fc阻断有效。相比之下,全染样本中IL-17A+细胞MFI为2,000,阴阳分离清晰(SI≈20)。若同型MFI显著高于未染(如500),则需检查Fc阻断剂量、死细胞比例或抗体浓度。FMO对照用于确认IL-17A门限,单阳对照(若涉及多色扩展)用于生成补偿矩阵。
这个例子展示了如何为单色实验中低表达抗原选择同型对照,强调严格匹配(种属、亚型、荧光素)、滴定一致、Fc阻断和死细胞排除的重要性,确保背景信号可信,为阈值设定提供参考。
同型对照为流式实验提供了重要的背景参照。它能够反映非特异性结合水平,帮助研究者识别体系噪声,从而提高信号判读的准确性。实验中需结合实验目的和样本特性灵活判断,合理设置同型对照,能有效提升数据的稳定性与可信度,为实验结果提供更科学的支撑。
关于我们

abinScience创立于法国,专注于高质量生命科学试剂的开发与生产,立足法国斯特拉斯堡创新科技中心,以“Empowering Bioscience Discovery”为愿景。其流式抗体产品覆盖常用检测指标,品类丰富,可满足多物种科研实验需求,为科研提供稳定可靠的支持,更多流式抗体列表详情可访问abinScience官方网站获取更多产品信息。
返回顶部