
在做外周血或组织单细胞悬液的流式检测时,红细胞(RBC)往往是“隐形的麻烦制造者”。它们数量庞大、体积小、无核且不携带目标免疫表位,容易掩盖白细胞信号、增加背景、干扰门控,甚至在染色、测定绝对计数时造成误判。因此,去除红细胞是获得干净、可重复流式结果的第一步。实验室常用去除红细胞的方法是用红细胞裂解液(Red Blood Cell Lysis Buffer,亦称 ACK Lysis Buffer)裂解样本中的红细胞。
1. 红细胞裂解液常规配方及裂解原理
表1:1×ACK lysis buffer
|
Reagent |
Quantity (for 500 mL) |
Final Concentration |
|
NH4Cl |
4.16 g |
150 mm |
|
KHCO3 |
0.5 g |
10 mm |
|
Na2EDTA |
0.02 g |
0.1 mm |
按照上表取NH?Cl 4.16 g、KHCO? 0.5 g、Na2EDTA 0.02 g溶于100 mL去离子水中,调节pH至7.2,然后补充去离子水至500 mL。4℃储存,使用时恢复至室温。
红细胞裂解液的核心成分是氯化铵。在裂解过程中,氨根离子(NH4?)无法通过细胞膜,而其他离子(如氯离子 Cl?)可以自由通过。这种选择性通透性导致细胞内外离子浓度差异,形成渗透压差。外部的水分会因渗透压差扩散至细胞内,使红细胞膨胀直至破裂,从而实现裂解效果。而有核细胞由于细胞膜结构和成分的差异,对裂解液的耐受性更强,不会受到损伤,从而实现红细胞与有核细胞的有效分离。
2. 红细胞裂解实验操作流程
(1)血液样本
①取100 μL新鲜抗凝血与离心管中,按照1:10-1:20的比例加入红细胞裂解液,混匀。
②室温或4℃裂解5-10 min,血液样本开始变透明。
③300-500×g离心5 min,用移液器小心吸弃上清。(如发现红细胞裂解不完全,可重复步骤①和步骤②依次,通常极微量的红细胞对后续实验影响较小)
④洗涤,加入2-5 mL的PBS、HBSS、生理盐水或无血清培养液,重悬沉淀,300-500×g离心2-3 min,弃上清。
⑤根据后续实验需要用适当溶液重悬细胞。
(2)组织样本
①新鲜组织经胰酶或胶原酶等消化分散成单个细胞悬液,离心弃上清。
②按 1:3-1:10的比例向细胞沉淀中加入裂解液,轻轻吹打混匀,裂解3-5 min。(具体时间需根据裂红效果来决定)
③加入5-10倍体积的PBS、HBSS、生理盐水或无血清培养液终止裂解。
④300-500×g离心5 min,弃上清。
⑤根据后续实验需要用适当溶液重悬细胞。
3.红细胞裂解常见问题
(1)如何判断裂解效果
①直接观察:裂解完全后溶液的颜色变清澈透明,如图1所示

图1. 红细胞裂解不全(左)VS红细胞裂解完全(右)
②上机检测:裂解完全的样本上机后细胞分群明显,如图2所示
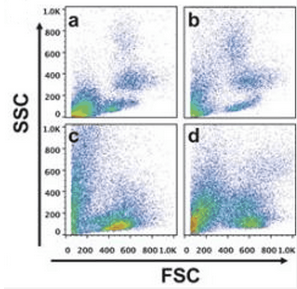
图2. 红细胞裂解完全(ab)VS红细胞裂解不全(cd)上机效果展示(图片来源于网络)
(2)红细胞裂解效果不佳
|
问题 |
可能原因 |
解决方案 |
|
裂解液使用不当 |
? 浓度错误(如10×储存液未稀释) |
? 确保使用1×工作液浓度 |
|
操作不当 |
? 裂解时间不足或过长 |
? 根据样本类型优化裂解时间 |
|
样本自身问题 |
? 抗凝效果不佳 |
? 使用新鲜有效抗凝的样本 |
(3)为什么小鼠&大鼠红细胞比较难裂解?
|
可能原因 |
解决方案 |
|
? 红细胞膜更坚韧:鼠类红细胞的膜富含胆固醇和鞘磷脂,结构更坚韧,不易破裂。 ? 红细胞体积小且膜厚:鼠类红细胞比人类红细胞更小,且膜更厚,增加了裂解难度。 ? 抗氧化能力强:鼠类红细胞具有较强的抗氧化能力,能抵抗裂解液中的氧化应激,导致裂解困难。 |
? 增加裂解液用量,并适当延长裂解时间。 ? 可进行多次裂解,但需小心不要过度裂解,以免影响白细胞的完整性。 |
关于我们
abinScience创立于法国,专注于高质量生命科学试剂的开发与生产,立足法国斯特拉斯堡创新科技中心,以“Empowering Bioscience Discovery”为愿景。abinScience流式抗体产品覆盖常用检测指标,品类丰富,可满足多物种(Human/Mouse/Rat/Dog/Hamster/Monkey等)科研实验需求,为科研提供稳定可靠的支持。
返回顶部